Etanol
| Etanol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Molécula de etanol |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificación | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nombre IUPAC | Etanol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sinónimos |
alcohol etílico |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.000.526 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CE | 200-578-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Código ATC | D08 , V03 , V03 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DrugBank | DB00898 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 702 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CHEBI | 16236 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o E | E1510 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FEMA | 2419 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sonrisas |
CCO , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / C2H6O / c1-2-3 / h3H, 2H2,1H3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | líquido incoloro con un olor característico. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades químicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fórmula bruta |
C 2 H 6 O [Isómeros] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa molar | 46,0684 ± 0,0023 g / mol C 52,14%, H 13,13%, O 34,73%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Momento dipolar | 1,66 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diámetro molecular | 0,469 nm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fusión | −114 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° hirviendo | 79 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilidad | en agua: miscible, Completo en disolventes polares y no polares ( acetona , éter dietílico ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parámetro de solubilidad δ |
26,0 MPa 1/2 ( 25 ° C ); 11,2 cal 1/2 · cm -3/2 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad |
0,789
ecuación:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura de autoignición |
423 a 425 ° C ; 363 ° C (según las fuentes) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| punto de inflamabilidad | vaso cerrado: 13 ° C puro 17 ° C 95 % vol . 21 ° C 70 % vol . 49 ° C 10 % vol . 62 ° C 5 % vol . |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Límites explosivos en el aire | Inferior: 3.3 % vol. Superior: 19 % vol. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor saturante | a 20 ° C : 5,8 kPa
ecuación:
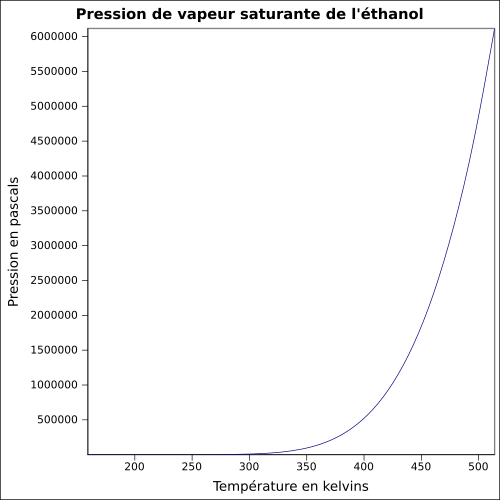
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Viscosidad dinámica | 1,20 × 10 −3 Pa s a 20 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto crítico | 240,85 ° C , 6,14 MPa , 0,168 l mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 1162 m s −1 a 20 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termoquímica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 líquido, 1 bar | 159,86 J · mol -1 · K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 gas | −235,3 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 líquido | −277,0 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p |
111 J · K -1 · mol -1
ecuación:
ecuación:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCS | 1366,8 kJ · mol -1 (líquido) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades electronicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 re energía de ionización | 10,43 ± 0,05 eV (gas) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cristalografía | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Clase de cristal o grupo espacial | Ordenador personal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parámetros de malla |
a = 5,377 Å b = 6.882 Å |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volumen | 298,57 Å 3 densidad = 0,7893 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades ópticas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Índice de refracción | 1.3594. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Precauciones | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Peligro H225, P210, P305 + P351 + P338, P370 + P378, P403 + P235, H225 : Líquido y vapores muy inflamables P210 : Mantener alejado de fuentes de calor, chispas, llama abierta o superficies calientes. - No fumar. P305 + P351 + P338 : En caso de contacto con los ojos: Enjuagar cuidadosamente con agua durante varios minutos. Quítese los lentes de contacto si la víctima los usa y se pueden quitar fácilmente. Continúe enjuagando. P370 + P378 : En caso de incendio: Utilizar… para apagarlo. P403 + P235 : Almacenar en un lugar bien ventilado. Mantener la calma. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 2 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transporte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
33 : líquido muy inflamable (punto de inflamación por debajo de 21 ° C ) Número ONU : 1170 : ALCOHOL ETILICO que contiene más del 24% de etanol, en volumen; SOLUCIÓN DE ALCOHOL ETILICO que contenga más del 24% de etanol, en volumen ETANOL que contiene más del 24 por ciento de etanol, en volumen; o SOLUCIÓN DE ETANOL que contenga más del 24 por ciento de etanol, por volumen Clase: 3 Etiqueta: 3 : Líquidos inflamables Empaque: Grupo de empaque II : sustancias de riesgo medio;  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Clasificación IARC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo 1: Carcinógeno para los seres humanos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inhalación | intoxicación, náuseas, vómitos | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Piel | sin efecto | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ojos | peligroso | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ingestión | intoxicación, náuseas, vómitos, coma etílico (que puede provocar la muerte) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ecotoxicología | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DL 50 | 5 hasta 20 g kg −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CL 50 | 20.000 a 30.000 ppm durante 4 a 6 horas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | -0,32 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Umbral de olor | bajo: 49 ppm alto: 716 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Datos farmacocinéticos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Metabolismo | en el hígado en etanal y luego en ácido acético , a ~ 100 mg kg -1 por hora | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Carácter psicotrópico | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoría | Depresivo | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Forma de consumir |
Ingestión |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Otros nombres |
Alcohol (ver Bebidas alcohólicas ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Riesgo de dependencia | Estudiante | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unidades de SI y STP a menos que se indique lo contrario. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El etanol, o alcohol etílico (o más simplemente alcohol ) es un alcohol de fórmula estructural CH 3 -CH 2 -OH. Es un líquido incoloro, volátil , inflamable y miscible con agua en todas las proporciones. Es una droga psicotrópica , y una de las drogas recreativas más antiguas , en forma de bebida alcohólica . El etanol se utiliza en la industria alimentaria (para la producción de bebidas espirituosas en particular), la perfumería y los productos farmacéuticos (como disolvente ), así como en el biocombustible ( bioetanol ). También se utiliza en termómetros de alcohol .
Fórmula
El etanol es un alcohol primario de dos carbonos de fórmula bruta C 2 H 6 Oy de fórmula semi-estructural CH 3 CH 2 OHo CH 3 -CH 2 -OH, lo que indica que el carbono del grupo metilo (CH 3 -) está unido al grupo metanodiilo (-CH 2 -) en sí mismo unido al grupo hidroxilo (-OH). Es un isómero de constitución del metiléter . El etanol generalmente se designa con la abreviatura "EtOH", el grupo etilo (C 2 H 5 -) siendo comúnmente abreviado "Y" en química orgánica .
apellido
Etanol es el nombre sistemático definido por la nomenclatura de compuestos orgánicos para una molécula con dos átomos de carbono (prefijo eth- ) que tienen un enlace sencillo entre ellos (sufijo -ane ) y están unidos a un grupo hidroxilo (sufijo -ol ).
Historia
La fermentación de azúcares en etanol es una de las biotecnologías más antiguas utilizadas por el ser humano, especialmente en la industria del alcohol y se ha utilizado desde tiempos prehistóricos para la obtención de bebidas alcohólicas . Los análisis químicos de los compuestos orgánicos absorbidos en tarros que datan del Neolítico encontrado en un pueblo en la provincia de Henan en China, , reveló que mezclas de bebidas fermentadas que consta de arroz, miel y frutas fueron producidos a partir de la VII º milenio antes de Cristo. AD .
Aunque la destilación es una técnica conocida alquimistas greco-egipcia (como Zósimo de Panópolis ), los primeros registros escritos de la producción de alcohol a partir del vino se remonta solamente XII ° siglo con el trabajo de los alquimistas de la Escuela de Medicina de Salerno . La primera mención de la distinción entre absolutos alcohol mezclas y agua-alcohol se informa a la XIII º siglo por Raymond Lully . Tenga en cuenta, sin embargo, que los persas aprendido Rhazes han aislado de etanol en la corriente X ª siglo.
En 1796 , Johann Tobias Lowitz obtuvo etanol puro filtrando etanol destilado a través de carbón activado . Antoine Lavoisier determina que el etanol está compuesto de carbono , oxígeno e hidrógeno , y en 1808 , Nicolas Théodore de Saussure determina su fórmula cruda . En 1858 , Archibald Scott Couper publicó la estructura química del etanol, que fue una de las primeras estructuras determinadas.
El etanol se preparó sintéticamente por primera vez en 1826 por el trabajo independiente de Georges Serullas en Francia y Henry Hennel en el Reino Unido . En 1828 , Michael Faraday sintetizó etanol mediante la hidratación catalizada por ácido del etileno , una síntesis similar al proceso industrial que se utiliza en la actualidad.
El etanol también se usó como combustible en lámparas y como combustible para automóviles hasta la década de 1930 . Por ejemplo, el Ford T podría funcionar hasta 1908 con etanol puro.
Presencia natural
El etanol es un subproducto volátil del metabolismo de las levaduras . Por tanto, está presente en el hábitat de estos organismos y en nuestra atmósfera. También se encuentra emitido por frutos maduros, y en muchas plantas debido a las condiciones anaeróbicas naturales durante la germinación o cuando las plantas que carecen de oxígeno (en caso de inundación por ejemplo) obtienen energía de la fermentación.
A principios de la década de 2000, su ciclo atmosférico todavía se conocía poco. Buscamos cuantificar el etanol emitido por plantas y levaduras, sus niveles en la atmósfera y su tasa de conversión a través del hidroxilo del aire (por titulación de metilcloroformo ). Una primera estimación aproximada arrojó una tasa de emisión de etanol por plantas de entre 10 y 38 Tg / año, es decir, una contribución importante al etanol total estimado que se introduce anualmente en la atmósfera (entre 25 y 56 Tg / año). Luego, un nuevo trabajo revisó al alza las emisiones de las plantas: 70 Tg / año (de 50 a 90 Tg / año), siendo en realidad destruido alrededor del 75% del etanol introducido del aire por reacción con radicales hidroxilo en aire seco o húmedo. También existen depósitos secos y húmedos en tierra seca.
También se ha detectado etanol en el espacio , cubriendo en forma sólida granos de polvo en nubes interestelares .
Propiedades fisicoquímicas
El etanol es un líquido volátil e incoloro que tiene olor. Su combustión es libre de humo y da una llama azulada. Las propiedades fisicoquímicas del etanol provienen principalmente de la presencia del grupo hidroxilo y la cadena de carbono corta . El grupo hidroxilo puede formar enlaces de hidrógeno , lo que hace que el etanol sea más viscoso y menos volátil que los disolventes orgánicos de pesos moleculares equivalentes. El índice de refracción del etanol es más alto que el del agua (1.3594 a 25.0 ° C ). El punto triple del etanol se observa a −123,15 ° C para una presión de 4,3 × 10 −4 Pa .
Propiedades como solvente
El etanol es un disolvente prótico polar . Es miscible con muchos disolventes orgánicos , como disolventes clorados ( tetracloruro de carbono , cloroformo , tricloroetano , tetracloroetileno ), hidrocarburos alifáticos ( pentano , hexano ), disolventes aromáticos ( benceno , tolueno , piridina ), ácido acético , acetona , éter dietílico. , el etilenglicol o el nitrometano . Sin embargo, la miscibilidad del etanol con hidrocarburos alifáticos tiende a disminuir con el aumento de la longitud de la cadena de carbono del alcano y la disminución de la temperatura, siendo el límite de miscibilidad, por ejemplo, 13 ° C para el dodecano .
Debido a la naturaleza polar del grupo hidroxilo , el etanol también puede disolver compuestos iónicos , tales como hidróxidos de sodio y potasio , cloruros de magnesio , calcio y amonio, o bromuros de amonio y sodio . Los cloruros de sodio y potasio son solo ligeramente solubles en etanol.
La parte no polar del etanol le permite disolver sustancias hidrófobas , en particular aceites esenciales y muchos compuestos aromáticos, colorantes y medicinales.
El etanol se puede utilizar como disolvente en muchas reacciones químicas durante la síntesis , como en las sustituciones nucleofílicas S N 1 , durante las hidrogenaciones catalíticas , durante las reacciones aldólicas , durante las reacciones de Wittig , durante las reacciones de Diels, aliso o durante las reacciones de diazotación .
El etanol es inerte frente a casi todas las superficies plastificadas de la vida cotidiana, barnices (excepto los de celulosa y los que tienen goma laca ), pinturas acrílicas y gliceroftálicas, siendo un muy buen disolvente. Esto lo convierte en un solvente de limpieza ampliamente utilizado solo o mezclado con otros compuestos.
Miscibilidad con agua
Las mezclas de agua y etanol ocupan un volumen menor que la suma de los volúmenes de los dos componentes tomados individualmente. La mezcla de un volumen de agua y un volumen de etanol da, por ejemplo, un volumen equivalente de 1,92. La reacción de mezclar agua y etanol es exotérmica y, a 24,85 ° C, se pueden liberar hasta 777 J mol -1 . La naturaleza polar del etanol lo hace higroscópico , tanto que, puro, absorbe la humedad del aire.
Se forma un azeótropo con agua a 89,47 % en moles de etanol y 10,53% en moles de agua a presión atmosférica . El punto de ebullición del etanol es de 78,4 ° C y de 100 ° C para el agua, pero el azeótropo hierve a 78,2 ° C , que es más bajo que los puntos de ebullición de cada uno de los componentes. Las proporciones de la mezcla azeotrópica varían en función de la presión.
| Presión | Punto de ebullición | Fracción molar de etanol |
|---|---|---|
| 0,1 MPa | 78,35 ° C | 0,894 |
| 0,344 MPa | 112,6 ° C | 0,882 |
| 0,689 MPa | 135,7 ° C | 0,874 |
| 1,378 MPa | 164,2 ° C | 0,862 |
| 2.068 MPa | 182,6 ° C | 0,852 |
Agregar un pequeño porcentaje de etanol al agua reduce drásticamente la tensión superficial del agua. Esta propiedad ayuda a explicar el fenómeno de las lágrimas de vino . Cuando se agita el vino en un vaso, el etanol se evapora más rápidamente en la fina película a lo largo de los lados del vaso. La proporción de etanol disminuye, por lo que aumenta la tensión superficial y la película se convierte en gotitas. Este fenómeno se llama efecto Marangoni y fue descrito y explicado en 1855 por James Thomson.
El grado alcohólico , también llamado grado alcohólico es la relación entre el volumen de alcohol contenido en la mezcla y el volumen total de la mezcla a 20 ° C . Se utiliza para determinar la proporción de alcohol, es decir, etanol, en una bebida alcohólica . La unidad utilizada para expresar el título es la fracción de volumen (% vol) o el grado (indicado "°").
Las mezclas de agua y etanol que contienen más del 50% de etanol son inflamables a temperatura ambiente , pero al calentarlas, una mezcla que contiene menos del 50% de etanol puede inflamarse. La técnica de cocción utiliza esta propiedad. El alcohol agregado en una sartén caliente se quema en llamas y produce una reacción compleja. La temperatura del alcohol que se quema puede superar los 240 ° C y conduce a la caramelización de los azúcares presentes.
Producción
El etanol se puede producir industrialmente a partir de productos petroquímicos mediante la hidratación del etileno y mediante la fermentación alcohólica de levaduras o celulosa . El proceso más económico depende principalmente del mercado del petróleo .
Catálisis directa
Este proceso, desarrollado en la década de 1970, ha suplantado por completo a otros métodos de producción. El etanol así producido es utilizado por la industria como materia prima o como disolvente . Se produce a través de petroquímicos , utilizando la hidratación por catálisis ácida de etileno , siguiendo la reacción:
H 2 C = CH 2+ H 2 O↔ CH 3 CH 2 OHEl catalizador más utilizado es el ácido fosfórico , adsorbido sobre una poroso de soporte tal como gel de sílice o celita . Un aumento de presión ayuda a desplazar el equilibrio hacia la producción de etanol, siguiendo el principio de Le Chatelier , y por lo tanto es utilizar un catalizador bajo alta presión de vapor de agua para acercarse al equilibrio rápidamente. El producto final es una mezcla de agua y etanol que contiene entre 10 % my 25 % m de etanol.
Catálisis indirecta
Un proceso anterior, pero ahora obsoleto, desarrollado en la década de 1930 por Union Carbide , y será utilizado durante gran parte del XX ° siglo . El etileno se esterifica con ácido sulfúrico para producir sulfato de etilo , que luego se hidroliza para producir etanol y ácido sulfúrico, que por lo tanto sirve como catalizador en esta reacción:
H 2 C = CH 2+ H 2 SO 4→ CH 3 CH 2 SO 4 H CH 3 CH 2 SO 4 H+ H 2 O→ CH 3 CH 2 OH+ H 2 SO 4Este proceso consume grandes cantidades de ácido sulfúrico y requiere una mezcla de gas de buena calidad como entrada.
Fermentación
El etanol utilizado en bebidas alcohólicas se produce por fermentación alcohólica . Asimismo, la mayor parte del bioetanol proviene del tratamiento de fermentación de plantas azucareras, como la remolacha y la caña de azúcar , o de cereales, como el maíz y el trigo . Ciertos tipos de levadura , como Saccharomyces cerevisiae , metabolizan los azúcares en etanol y dióxido de carbono , siguiendo estas reacciones:
C 6 H 12 O 6→ 2 CH 3 CH 2 OH+ 2 CO 2 C 12 H 22 O 11+ H 2 O→ 4 CH 3 CH 2 OH+ 4 CO 2La fermentación es la levadura se cultiva en condiciones favorables para producir el alcohol, a una temperatura de aproximadamente 35 a 40 ° C . Las cepas de levadura más resistentes pueden sobrevivir a una concentración de aproximadamente 15 % en volumen de etanol. La toxicidad del etanol para la levadura limita la concentración de alcohol que se puede obtener mediante la elaboración de cerveza , y se pueden obtener concentraciones más altas mediante mutilación o destilación . Durante la fermentación se forman productos secundarios como el glicerol , el ácido succínico , el ácido acético y el alcohol amílico .
Para producir etanol a partir de almidón , por ejemplo a partir de semillas de cereales, primero debe convertirse en azúcares. Cuando se elabora cerveza, se deja germinar una semilla ( malteado ), lo que permite la producción de ciertas enzimas, como citasas , amilasas , fosfatasas o peptidasas , necesarias para la sacarificación del almidón. Para el bioetanol , este proceso puede acelerarse utilizando ácido sulfúrico o utilizando una amilasa producida a partir de hongos.
Etanol celulósico
La fermentación también se puede obtener a partir de la celulosa , pero hasta hace poco el costo de la celulasa , una enzima capaz de descomponer la celulosa, no permitía que la industria se desarrollara industrialmente. En 2004 , la empresa canadiense Iogen Corporation construyó la primera planta basada en la producción de etanol a partir de celulosa. El desarrollo de esta tecnología podría permitir utilizar y reciclar una gran cantidad de residuos vegetales de la agricultura que contienen celulosa, como aserrín o paja . Actualmente, otras empresas de biotecnología están desarrollando hongos capaces de producir grandes cantidades de celulasa y xilanasa para convertir otros residuos agrícolas en celulosa, como los desechos de maíz o el bagazo de la caña de azúcar .
Purificación
Los diversos procesos de producción de etanol producen mezclas de agua y etanol. Para su uso en la industria o como combustible, el etanol debe estar purificado. La destilación fraccionada puede concentrarse etanol a 95,6 % vol (89,5 % en moles ) y forma una mezcla azeotrópica con agua, cuyo punto de ebullición es 78,2 ° C . Los métodos habituales de obtención de etanol absoluto incluyen el uso de desecantes , como almidón , glicerol o zeolitas , destilación azeotrópica y destilación extractiva .
Cualidades del etanol
Hay diferentes grados de etanol disponibles para diferentes usos:
- el alcohol desnaturalizado es generalmente etanol al que se le añade un desnaturalizante para que la mezcla no sea apta para el consumo alimentario. Los desnaturalizantes utilizados pueden ser alcohol isopropílico , metanol , ftalato de dietilo , tiofeno , éter dietílico o también condensados de gas natural . Se utiliza para tareas domésticas, limpieza, desinfección y en estufas de alcohol . Disolvente de ebanistería para sus barnices de goma laca , también es un desengrasante en la industria, apreciado por su baja toxicidad en la piel. Generalmente al 95 % en volumen ;
- El alcohol metilado es una mezcla de etanol y metanol . El alcohol metilado es muy tóxico debido a la presencia de metanol (generalmente del 5 al 10 % en volumen ). Se utiliza para limpiar ventanas y superficies plásticas;
- el alcohol rectificado es un destilado que mide de 70 a 96% vol de etanol utilizando el método de destilación fraccionada . La concentración máxima que puede obtenerse por destilación de alcohol crudo es 96 % vol debido a la formación de un azeótropo agua-etanol. Se utiliza para hacer licores o vodka , pero también para el mantenimiento, limpieza o desinfección del hogar;
- el etanol absoluto es etanol que contiene un máximo de 1% de agua, pero la mayoría de los principales proveedores de química venden bajo el término etanol absoluto etanol 99,8%. Se utiliza como disolvente para aplicaciones industriales y de laboratorio y como combustible;
- El etanol anhidro es etanol del que se ha eliminado el agua en la mayor medida posible. Por ejemplo, la reacción de etanol absoluto con magnesio metálico seguida de destilación a presión atmosférica produce etanol a 50 ppm de agua (0,005% de agua en masa o 1 / 20.000). Este grado de etanol permite su uso en reacciones sensibles a la humedad.
Reactividad y reacciones
El etanol es un alcohol primario y un ácido débil ( p K a = 15,5) cuya base conjugada es el etanolato . También es un buen nucleófilo , debido a la reactividad de los dobletes que no se unen al oxígeno. Su reactividad, debido principalmente a la presencia del grupo hidroxilo , puede implicar reacciones de deshidratación , deshidrogenación , oxidación y esterificación .
Química ácido-base
El etanol es una molécula neutra y el pH de una solución de etanol en agua es 7,00. El etanol se puede convertir cuantitativamente en su base conjugada , el ion etanolato , haciéndolo reaccionar con un metal alcalino , como el sodio :
2 CH 3 CH 2 OH+ 2 Na→ 2 CH 3 CH 2 ONa+ H 2o con una base fuerte , como hidruro de sodio :
CH 3 CH 2 OH+ NaH→ CH 3 CH 2 ONa+ H 2Esterificación
El etanol reacciona con ácidos carboxílicos en presencia de un ácido fuerte ( catálisis ) para dar ésteres etílicos y agua de acuerdo con la siguiente reacción:
RCOOH+ CH 3 CH 2 OH→ RCOOCH 2 CH 3+ H 2 OEsta reacción es reversible y el equilibrio se alcanza lentamente, requiriendo el uso de catalizadores ácidos, como ácido sulfúrico , ácido clorhídrico , trifluoruro de boro o ácido paratoluenosulfónico . Para lograr rendimientos correctos, esta reacción, que se utiliza en la industria a gran escala, requiere la eliminación del agua de la mezcla de reacción a medida que se forma. El etanol también puede formar ésteres con ácidos inorgánicos y permite preparar compuestos ampliamente utilizados en síntesis orgánica , como el sulfato de dietilo (C 2 H 5 ) 2 SO 4o trietilfosfato (C 2 H 5 ) 3 PO 4. El nitrito de etilo CH 3 CH 2 O-N = Otambién se puede preparar a partir de etanol y nitrito de sodio , y se usaba comúnmente como diurético o remedio para la gripe o el resfriado común , antes de ser retirado del mercado a principios de la década de 1980 .
La reacción de saponificación , que permite reformar el etanol a partir de ésteres etílicos en presencia de un ácido o una base para dar un carboxilato , se utiliza para la preparación de jabones .
Deshidración
El uso de ácidos fuertes puede permitir que el etanol se deshidrate para formar éter dietílico , y cada año se producen varias toneladas de éter dietílico utilizando ácido sulfúrico como catalizador . La reacción se puede describir de la siguiente manera:
2 CH 3 CH 2 OH→ CH 3 CH 2 OCH 2 CH 3+ H 2 O(a 120 ° C )El etileno es el producto principal cuando la temperatura supera los 160 ° C :
CH 3 CH 2 OH→ H 2 C = CH 2+ H 2 OCombustión
La combustión del etanol es humo y da una llama azulada. La reacción de combustión forma dióxido de carbono y vapor de agua :
CH 3 CH 2 OH( l ) + 3 O 2( g ) → 2 CO 2( g ) + 3 H 2 O( g )El poder calorífico (Δ c H °) de la combustión de etanol es 1366.8 kJ mol -1 a 25 ° C , y la capacidad calorífica específica (C v ) es 2.438 kJ kg -1 K -1 .
Oxidación
La oxidación (o deshidrogenación ) del etanol en presencia de catalizadores permite obtener etanal (o acetaldehído ), según la siguiente reacción:
CH 3 CH 2 OH→ CH 3 CHO+ H 2En los hepatocitos del hígado , la enzima alcohol deshidrogenasa convierte de manera similar el etanol en etanal. El etanal es más tóxico que el etanol y podría ser responsable de muchos síntomas de resaca , aunque no está presente en la sangre durante los síntomas. En el cerebro , la alcohol deshidrogenasa tiene un papel menor en la conversión de etanol en etanal, y es la enzima catalasa la que cataliza principalmente esta reacción.
Las etapas finales de la fermentación alcohólica implican la conversión de piruvato en etanal por la enzima piruvato descarboxilasa , seguida de la reducción (o hidrogenación ) de etanal a etanol por la enzima alcohol deshidrogenasa , en este caso catalizando la reacción opuesta. Como metabolito endógeno, el etanal es tóxico y se sospecha que es carcinógeno. Daña las células madre hematopoyéticas (encargadas de renovar constantemente la sangre ); por un lado es la fuente de roturas en el ADN bicatenario de estas células (lo que promueve su declive y crea reordenamientos cromosómicos ), y por otro lado impide la reparación adecuada ( p. 53 ) de este daño, lo que causa neoplasias.
Halogenación
El etanol reacciona con ácidos hidrohálicos para producir haloalcanos , como cloroetano y bromoetano , mediante una reacción S N 2 :
CH 3 CH 2 OH+ HCl→ CH 3 CH 2 Cl+ H 2 OEsta reacción requiere el uso de un catalizador , como el cloruro de zinc . Los haluros de alquilo también se pueden sintetizar utilizando agentes halogenantes como cloruro de tionilo o tribromuro de fósforo :
CH 3 CH 2 OH+ SOCl 2→ CH 3 CH 2 Cl+ SO 2+ HClReacción de haloformo
La reacción del haloformo es una reacción química que consiste en sintetizar un trihalogenometano , como el cloroformo (CHCl 3), bromoformo (CHBr 3) o yodoformo (CHI 3), y es una de las reacciones orgánicas más antiguas descritas como tal. En 1822 , Georges Serullas informó de la reacción del etanol con diodo e hidróxido de sodio en agua, formando formiato de sodio y yodoformo , entonces llamado "hidroyoduro de carbono".
El etanol reacciona con hipoclorito de sodio para dar cloroformo, de acuerdo con la siguiente síntesis:
CH 3 CH 2 OH+ NaClO→ CH 3 CHO+ NaCl+ H 2 O CH 3 CHO+ 3 NaOCl→ CCl 3 CHO+ 3 NaOH CCl 3 CHO+ NaOH→ CHCl 3+ HCO 2 NaAsimismo, el bromoformo y el yodoformo se obtienen respectivamente del hipobromito de sodio y del hipoyodito de sodio. El etanol es el único alcohol primario que permite esta reacción.
usar
Combustible
El etanol producido en todo el mundo se utiliza principalmente como combustible . La cantidad de etanol puede variar desde un pequeño porcentaje en gasolina en Europa Occidental hasta 95 % vol en gasolina en Brasil , donde el 90% de los vehículos nuevos utilizan la técnica de combustible flexible y pueden funcionar con esta mezcla. Más del 66% del etanol utilizado como combustible procede de la fermentación alcohólica .
El combustible E85 distribuido en Francia contiene entre 65% y 85% de bioetanol, siendo el resto gasolina; la tasa varía entre el 65% y el 75% en invierno y alcanza el 85% en verano.
Asociado al agua, fue el combustible de muchos aviones ( motores de combustión interna ) y cohetes durante la Segunda Guerra Mundial, para países con pocos recursos petrolíferos.
En Francia, el 1% de la tierra se dedica al bioetanol. De los dieciocho millones de hectolitros producidos en Francia anualmente, doce millones se utilizan para fabricar biocombustibles, de los cuales el 30% se comercializa fuera de Francia. De los ocho millones de hectolitros de bioetanol destinados a biocombustible en Francia, un millón (o el 12%) se utiliza en combustible E85 . También se utiliza una pequeña cantidad de etanol para fabricar ED95 (95% de bioetanol y 5% de aditivo de procetano) para vehículos pesados específicamente motorizados (incluidos autobuses y autocares).
Bebidas alcohólicas
El contenido de etanol (o grado de alcohol ) de las bebidas alcohólicas varía según el modo de producción y la materia prima. La mayoría de las bebidas alcohólicas se pueden clasificar entre bebidas fermentadas y licores . Las principales bebidas fermentadas son las cervezas , elaboradas a partir de cereales u otras plantas productoras de almidón , vinos y sidras , elaborados a partir de zumos de frutas y aguamiel , elaborado a partir de miel . Las bebidas espirituosas se producen mediante la destilación de bebidas fermentadas . Podemos distinguir diferentes tipos de bebidas espirituosas , como el whisky , destilado de semillas de cereal fermentado, aguardiente , destilado de jugo de fruta fermentado, o ron , destilado de melaza o jugo de caña de azúcar . Muchos aguardientes y licores también se preparan infundiendo frutas, hierbas y especias en bebidas espirituosas , como la ginebra, que se crea infundiendo bayas de enebro en alcohol rectificado .
Se pueden usar otros métodos para aumentar el nivel de alcohol , como la solidificación fraccionada , que se usa para hacer applejack a partir del jugo de manzana. El vino fortificado se prepara agregándolo al agua de la vida u otras bebidas espirituosas al vino parcialmente fermentado, método que elimina las levaduras y mantiene algunos de los azúcares.
Las bebidas alcohólicas se utilizan en la cocina por su aroma y porque el alcohol disuelve los compuestos olorosos hidrófobos . El etanol de estas bebidas también se usa para producir vinagre , de la misma manera que el etanol industrial se usa para la producción de ácido acético .
Materia prima
El etanol es un intermedio sintético importante en la industria química . Se utiliza en particular durante la preparación de halogenuros de etilo, ésteres etílicos , aminas etílicas , éter dietílico , ácido acético y, en menor medida, butadieno .
Antiséptico
El etanol se utiliza en el campo médico en compresas como antiséptico . También se utiliza en soluciones hidroalcohólicas a una concentración de aproximadamente 60 % vol . El etanol mata a los organismos desnaturalizando sus proteínas y disolviendo sus lípidos. Es eficaz contra la mayoría de las bacterias y hongos , muchos virus , pero es ineficaz contra las esporas .
Solvente
El etanol es miscible con agua y es un buen disolvente . Se puede encontrar en pinturas , tintes industriales, barnices tradicionales, bebidas alcohólicas , rotuladores y en cosméticos como perfumes y desodorantes .
Uso medico
El etanol absoluto a veces se inyecta en los tumores para provocar su necrosis . Sin embargo, no tiene una actividad específica ya que causa indiscriminadamente necrosis de tejidos sanos y cancerosos.
El etanol también se usa para tratar la intoxicación por metanol o etilenglicol . En estos casos, el etanol compite con otros alcoholes para ser metabolizado por la enzima alcohol deshidrogenasa , reduciendo así los derivados tóxicos que resultan de su metabolización en aldehídos y ácidos carboxílicos , y reduciendo los efectos tóxicos por cristalización de oxalato de calcio (de etilenglicol ) en los riñones .
Usos históricos
Antes del desarrollo de las medicinas modernas, el etanol se usaba para diversos fines médicos, incluido el tratamiento de la depresión y como anestésico . También se sabe que puede servir como suero de la verdad .
Como combustible , se utilizó en motores de cohetes combinados con oxígeno líquido . Durante la Segunda Guerra Mundial , el misil alemán " V2 " usó etanol mezclado con 25 % en volumen de agua para bajar la temperatura de la cámara de combustión . El misil balístico estadounidense " PGM-11 Redstone ", inspirado en el diseño del V2 alemán, también usaba etanol mezclado con oxígeno líquido . Posteriormente, los combustibles a base de alcohol para cohetes y misiles cayeron en desuso a medida que se desarrollaron nuevos combustibles.
Farmacología
Las dos rutas principales de metabolismo del etanol en el hígado son la alcohol deshidrogenasa y el sistema de oxidación etanol microsomal (in) . A bajas concentraciones de etanol, la alcohol deshidrogenasa oxida el etanol a acetaldehído , pero a concentraciones más altas, o con dosis repetidas de etanol, predomina el sistema de oxidación microsomal de etanol.
En la Farmacopea Europea , “etanol” designa etanol anhidro, es decir 100% puro, en contraposición al etanol al 95 % vol o al 70 % vol que se puede encontrar en las farmacias . A esto se suma la calidad “alcohol Ph. Eur. "(Para la Farmacopea Europea ), que designa una calidad de etanol para la que se han cuantificado numerosas trazas e impurezas.
Propiedades fisiologicas
Existen diferentes efectos de las bebidas alcohólicas , siendo el alcoholismo el consumo excesivo de bebidas que contienen etanol el que conduce a la dependencia, lo que clasifica al etanol como droga. Esta sería la droga más dañina para las sociedades.
| Nivel de alcohol en sangre ( g · l –1 ) |
Nivel de alcohol ( % vol ) |
Síntomas |
|---|---|---|
| 0,5 | 0,05 | Euforia, relajación |
| 1.0 | 0,1 | Depresión, náuseas, vómitos, disminución de las habilidades motoras y sensoriales, cognición lenta |
| > 1,4 | > 0,14 | Disminución del flujo sanguíneo al cerebro. |
| 3,0 | 0,3 | Pérdida de consciencia |
| 4.0 | 0.4 | Posible muerte |
| 5.5 | 0,55 | Muerte |
Alcohol en sangre
El BAC es la cantidad de etanol en la sangre; generalmente se expresa en gramos por litro de sangre. Los niveles de alcohol en sangre superiores a 4.0 g L -1 pueden ser fatales y el nivel se vuelve letal por encima de 5.5 g L -1 . Las dosis bajas de etanol, por debajo de 0,5 g L -1 , provocan una sensación de euforia , y las personas se vuelven más comunicativas, menos inhibidas y muestran una menor capacidad analítica. En dosis más altas, por encima de 1.0 g L -1 , el etanol actúa como un depresor del sistema nervioso central , síntomas que involucran cognición lenta , disminución de la función sensorial y motora, pérdida del conocimiento , hasta la muerte.
Efectos del sistema nervioso central
El etanol es un depresor del sistema nervioso central y se considera un fármaco psicotrópico . Actúa sobre el sistema nervioso central al interactuar principalmente con los receptores GABA A , aumentando el efecto inhibidor del neurotransmisor ácido γ-aminobutírico (o GABA). GABA ralentiza la actividad de las neuronas (a diferencia del glutamato, que es un acelerador de la información); por lo tanto, al unirse a los receptores GABA, el etanol exagera la ralentización del cerebro . Por tanto, actúa como modulador alostérico positivo . El etanol también actúa sobre los receptores de serotonina , glutamato , acetilcolina y dopamina . Sus efectos negativos pueden verse agravados por el plomo, que aumenta el estrés oxidativo . El plomo potencia el efecto del alcohol en el sistema nervioso central (SNC).
Por tanto, el consumo prolongado de etanol puede provocar daños permanentes en el cerebro y otros órganos. La abstinencia de alcohol puede provocar diversos síntomas como trastorno por déficit de atención , aumento de la sudoración, taquicardia , temblores de (temblor de las extremidades), a veces náuseas o vómitos, deshidratación, malestar , de la hipertensión . A veces se acompaña de un ataque de epilepsia , alucinaciones visuales, táctiles o auditivas, es delirium tremens en su forma más severa. Con el tiempo, y en casos raros, puede aparecer dolor desde la mandíbula hasta el cráneo. También se ha demostrado que el etanol provoca cambios en el tamaño de la materia gris visible a simple vista .
Efectos sobre el metabolismo
Como tal, el etanol es un nutriente . En el cuerpo humano, la enzima alcohol deshidrogenasa lo metaboliza a acetaldehído . El acetaldehído es posteriormente convertido por la acetaldehído deshidrogenasa en acetil-coenzima A , que es el producto final del metabolismo de carbohidratos y lípidos . Sin embargo, el acetaldehído en sí mismo es mucho más tóxico que el etanol y es en parte responsable de la mayoría de los efectos clínicos del alcohol, como la resaca . En particular, se ha demostrado que aumenta el riesgo de cirrosis del hígado y está vinculada a muchas formas de cáncer .
Efectos a largo plazo
El etanol está clasificado como un agente teratogénico y puede inducir el síndrome de alcoholismo fetal , que es la intoxicación por alcohol del embrión o el feto debido al consumo de alcohol de la madre durante el embarazo y que altera los órganos de desarrollo.
El consumo regular de alcohol también es un factor que contribuye al aumento de los triglicéridos en sangre lo que favorece la aparición de enfermedades cardiovasculares .
El etanol en las bebidas alcohólicas se considera un carcinógeno definitivo y, por lo tanto, es uno de los carcinógenos del Grupo 1 de la IARC .
Interacciones de drogas
El etanol puede incrementar el fenómeno de sedación causado por fármacos depresores que actúan sobre el sistema nervioso central , como los barbitúricos , las benzodiazepinas , los opioides , las fenotiazinas y los antidepresivos .
Notas y referencias
- (fr) Este artículo está tomado parcial o totalmente del artículo de Wikipedia en inglés titulado " Etanol " ( consulte la lista de autores ) .
- ETANOL (ANHYDRO) , hoja (s) de seguridad del Programa Internacional de Seguridad Química , consultado el 9 de mayo de 2009
- (en) Y. Marcus , Las propiedades de los disolventes , Chichester, Inglaterra, John Wiley & Sons , al. "Química de la solución" ( n o 4),1998, 254 p. ( ISBN 978-0-471-98369-9 y 0471983691 , LCCN 98018212 , presentación en línea ) , pág. 95
- Marcus, 1998 , p. 88.
- masa molecular calculada de " pesos atómicos de los elementos 2007 " en www.chem.qmul.ac.uk .
- (en) James E. Mark, Manual de propiedades físicas del polímero , Springer,2007, 2 nd ed. , 1076 p. ( ISBN 978-0-387-69002-5 y 0-387-69002-6 , leer en línea ) , pág. 294
- (in) Serban Moldoveanu, Preparación de muestras en cromatografía , Amsterdam / Boston, Elsevier ,2002, 930 p. ( ISBN 0-444-50394-3 ) , pág. 258
- " hoja toxicológica FT 48 - Etanol " , en la página web del Instituto Nacional de Investigación y Seguridad para la prevención de accidentes de trabajo y enfermedades profesionales ,2011(consultado el 14 de mayo de 2012 ) .
- (in) RH Perry y DW verde , los ingenieros químicos Handbook de Perry , McGraw-Hill ,1997, 7 ª ed. , 2640 p. ( ISBN 978-0-07-049841-9 , LCCN 96051648 ) , pág. 2-50.
- (in) CA Faúndez y OJ Valderrama , " Modelos de coeficientes de actividad para describir el equilibrio vapor-líquido en soluciones hidroalcohólicas ternarias " , Chin. J. Chem. Eng. , vol. 17, n o 2abril de 2009, p. 259-267 ( ISSN 1004-9541 , DOI 10.1016 / S1004-9541 (08) 60203-7 )
- (en) William M. Haynes , Manual CRC de Química y Física , Boca Raton, CRC Press / Taylor y Francis,1 er de julio de 2010, 91 ª ed. , 2610 p. ( ISBN 9781439820773 , presentación en línea ) , p. 14-40
- (en) O. Haida , H. Suga et al. , “ Estudio calorimétrico del estado vítreo XII. Fenómenos plurales de transición vítrea del etanol ” , J. Chem. Termodinámica. , vol. 9, n o 12,Diciembre de 1977, p. 1133-1148 ( ISSN 0021-9614 , DOI 10.1016 / 0021-9614 (77) 90115-X ).
- (en) J. Chao y FD Rossini , " Calores de combustión, entrenamiento e isomerización de alcanoles diecinueve " , J. Chem. Eng. Datos , vol. 10, n o 4,1965, p. 374–379 ( ISSN 0021-9568 , DOI 10.1021 / je60027a022 ).
- (en) Carl L. Yaws, Manual de diagramas termodinámicos: compuestos orgánicos C8 a C28 , vol. 1, Huston, Texas, Pub del Golfo. Co.,1996, 396 p. ( ISBN 978-0-88415-857-8 , LCCN 96036328 )
- (en) David R. Lide , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press,18 de junio de 2002, 83 ª ed. , 2664 p. ( ISBN 0849304830 , presentación en línea ) , p. 5-89
- (en) David R. Lide , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press / Taylor y Francis,17 de junio de 2008, 89 ª ed. , 2736 p. ( ISBN 9781420066791 , presentación en línea ) , p. 10-205
- " Ethanol " , en reciprocalnet.org (visitada 12 de diciembre 2009 )
- [1]
- Grupo de trabajo de la IARC sobre la evaluación de riesgos carcinogénicos para los seres humanos, " Evaluaciones globales de carcinogenicidad para los seres humanos, Grupo 1: Carcinógeno para los seres humanos " , en http://monographs.iarc.fr , IARC,16 de enero de 2009(consultado el 22 de agosto de 2009 )
- Ficha de seguridad proporcionada por Sigma-Aldrich, consultada el 28/09/2019
- " Ethyl alcohol " , en hazmap.nlm.nih.gov (consultado el 14 de noviembre de 2009 )
- " ESIS " (consultado el 6 de diciembre de 2008 )
- (in) GP Moss ( eds. ), " Terminología básica de estereoquímica " , Pure Appl. Chem. , IUPAC , vol. 68, n o 12,1996, p. 2193-2222 ( ISSN 0033-4545 y 1365-3075 , DOI 10.1351 / pac199668122193 ).
- (en) PE McGovern , J. Zhang et al. , “ Bebidas fermentadas de la China pre y protohistórica ” , Proc. Natl. Acad. Sci. Estados Unidos , vol. 101, n o 51,21 de diciembre de 2004, p. 17593-17598 ( ISSN 0027-8424 , PMID 15590771 , PMCID PMC539767 , DOI 10.1073 / pnas.0407921102 , leer en línea ).
- (en) RJ Forbes , Una breve historia del arte de la destilación: Desde los inicios hasta la muerte de Cellier Blumenthal , Leiden, Países Bajos, Brill ,1970, 2 nd ed. ( 1 st ed. 1948), 405 p. ( ISBN 978-90-04-00617-1 , presentación en línea , leer en línea ) , pág. 89.
- " Mohammad Ibn Zakariâ Râzi (865-925), El médico más eminente de la civilización islámica - La Revue de Téhéran | Irán ” , en www.teheran.ir (consultado el 9 de julio de 2016 )
- (in) " Alcohol " , en el sitio de la Encyclopaedia Britannica ,1911(consultado el 12 de mayo de 2012 ) .
- (en) AS Cut , " fue una nueva teoría química " , Philos. revista , 4 th series, vol. dieciséis,1858, p. 104-116 ( ISSN 1478-6435 , leer en línea ).
- (en) H. Hennell , " Sobre la acción mutua del ácido sulfúrico y el alcohol, con comentarios sobre la composición y propiedades del compuesto resultante " , Philos. Trans. R. Soc. , vol. 116,9 de marzo de 1826, p. 240-249 ( DOI 10.1098 / rstl.1826.0021 , leer en línea ).
- (en) Joseph DiPardo, " Outlook for Biomass Ethanol Production and Demand " , en Energy Information Administration (consultado el 14 de mayo de 2012 )
- (en) VD Hunt , The gasohol handbook , New York Industrial Press,1981, 580 p. ( ISBN 978-0-8311-1137-3 , presentación en línea ).
- (En) R. Dudley , " Maduración de la fruta con etanol y los orígenes históricos del alcoholismo de primates humanos en Frugivory " , Integr. Comp. Biol. , vol. 44, n o 4,2004, p. 315-323 ( ISSN 1540-7063 , DOI 10.1093 / icb / 44.4.315 ).
- Kreuzwieser J, Papadopoulou E & Rennenberg H (2004) Interacción de las inundaciones con el metabolismo del carbono de los árboles forestales , Plant Biol., 6, 299-306, 2004
- Kimmerer TW y MacDonald RC (1987) Biosíntesis de acetaldehído y etanol en hojas de plantas , Plant Physiol., 84, 1204-1209
- (en) S. Leblová E. Sineckáet et al. , “ Metabolismo del piruvato en semillas en germinación durante la anaerobiosis natural ” , Biol. Plantarum , vol. 16, n o 6,1974, p. 406-411 ( ISSN 0006-3134 , DOI 10.1007 / BF02922229 ).
- Kirstine WV y Galbally IE (2011) El etanol de presupuesto atmosférico global revisado ; Química atmosférica y física 11 (1): 25909-25936 | Septiembre | DOI: 10.5194 / acpd-11-25909-2011
- (en) A. Schriver , L. Schriver-Mazzuoli et al. , “ Un posible origen del etanol en medio interestelar: fotoquímica de películas mixtas de CO 2- C 2 H 6 a 11 K. Un estudio FTIR ” , Chem. Phys. , vol. 334, n hueso 1-3,2007, p. 128-137 ( DOI 10.1016 / j.chemphys.2007.02.018 ).
- (en) M. Windholz ( ed. ), The Merck Index: An Enciclopedia de Químicos y Drogas , vol. 9, Merck ,1976, 9 ª ed. , 1835 p. ( ISBN 978-0-911910-26-1 ).
- (en) U. Dahlmann y GM Schneider , “ Equilibrios de fase (líquido + líquido) y curvas críticas de (etanol + dodecano o tetradecano o hexadecano o 2,2,4,4,6,8,8-heptametilnonano) de 0 , 1 MPa a 120,0 MPa ” , J. Chem. Termodinámica. , vol. 21, n o 9,Septiembre de 1989, p. 997–1004 ( ISSN 0021-9614 , DOI 10.1016 / 0021-9614 (89) 90160-2 ).
- (en) C. Reichardt y T. Welton , Disolventes y efectos de los disolventes en química orgánica , Weinheim, Wiley-VCH ,2010, 4 ª ed. , 692 p. ( ISBN 978-3-527-32473-6 , DOI 10.1002 / 9783527632220 , presentación en línea ) , “Apéndice” , p. 568.
- (en) JE Logsdon , Enciclopedia Kirk-Othmer de Tecnología Química , John Wiley & Sons ,2004( ISBN 978-0-471-23896-6 , DOI 10.1002 / 0471238961.0520080112150719.a01.pub2 , leer en línea ) , "Etanol".
- (en) MJ Costigan , LJ Hodges et al. , “ El calorímetro de desplazamiento isotérmico: modificaciones de diseño para medir las entalpías exotérmicas de mezcla ” , Aust. J. Chem. , vol. 33, n o 10,1980, p. 2103-2119 ( ISSN 0004-9425 , DOI 10.1071 / CH9802103 ).
- (en) RW Rousseau , Manual de tecnología de procesos de separación , John Wiley & Sons ,1987, 1010 p. ( ISBN 978-0-471-89558-9 , leer en línea ) , pág. 261–262.
- J. Vidal , Termodinámica: aplicación a la ingeniería química y la industria del petróleo , París, Éditions Technip ,1997, 500 p. ( ISBN 978-2-7108-0715-5 , LCCN 97194455 , leer en línea ) , p. 181.
- (en) J. Thomson , " hay algunos movimientos curiosos observables en la superficie del vino y otros licores alcohólicos " , Philos. revista , vol. 10,1855, p. 330-333 ( leer en línea ).
- (en) GA Mills y EE Ecklund , " Alcoholes como componentes de combustibles de transporte " , Annu. Rvdo. Energía Aprox. , vol. 12,Noviembre de 1987, p. 47-80 ( DOI 10.1146 / annurev.eg.12.110187.000403 ).
- (en) PB Morais , CA Rosa et al. , “ Producción de alcohol combustible por cepas de Saccharomyces de hábitats tropicales ” , Biotechnol. Lett , vol. 18, n o 11,1996, p. 1351-1356 ( ISSN 0141-5492 , DOI 10.1007 / BF00129969 ).
- (en) PC Badger , J. Janick ( ed. ) Y A. Whipkey ( eds. ), Tendencias en nuevos cultivos y nuevos usos , Alexandria, VA, ASHS Press,2002, 599 p. ( ISBN 978-0-09-707565-5 , leer en línea ) , “Etanol de celulosa: una revisión general” , p. 17-21.
- (in) MJ Taherzadeh y K. Karimi , " Procesos de hidrólisis basados en ácidos para etanol a partir de materiales lignocelulósicos: una revisión " , BioRes. , vol. 2 n o 3,2007, p. 472-499 ( ISSN 1930-2126 , leer en línea ).
- (in) MJ Taherzadeh y K. Karimi , " Procesos de hidrólisis basados en enzimas para etanol a partir de materiales lignocelulósicos: una revisión " , BioRes. , vol. 2, n o 4,2007, p. 707-738 ( ISSN 1930-2126 , leer en línea ).
- (in) SK Ritter , " Explosión de oro de biomasa: La tecnología para utilizar azúcares derivados de plantas para producir materias primas químicas está lista y esperando ... " , Chem. Eng. Noticias , vol. 82, n o 22,Mayo de 2004, p. 31-34 ( ISSN 0009-2347 , leer en línea ).
- (en) " Brew Better Ethanol " en Popular Science Online ,2006(consultado el 18 de mayo de 2012 ) .
- (en) DR Lide ( eds. ), CRC Handbook of Chemistry and Physics , Boca Raton, FL, CRC Press ,2007, 88 ª ed. , 2640 p. ( ISBN 978-0-8493-0488-0 ) , cap. 8 ("Química analítica") , pág. 42.
- (en) HD Hinton y JA Nieuwland , " Reacciones orgánicas con fluoruro de boro. I. La preparación de ésteres ” , J. Am. Chem. Soc. , vol. 54, n o 5,1932, p. 2017–2018 ( ISSN 0002-7863 , DOI 10.1021 / ja01344a046 ).
- (in) " Rulemaking History for OTC Sweet Spirits of Nitre Drug Products " en la Administración de Alimentos y Medicamentos (consultado el 22 de mayo de 2012 ) .
- (en) K. Schumann y K. Siekmann , Enciclopedia de química industrial de Ullmann , Wiley-VCH Verlag ,2000( ISBN 978-3-527-30673-2 , presentación en línea ) , "Jabones".
- Lide, 2007 , cap. 5 ("Termoquímica, electroquímica y cinética"), pág. 70.
- Lide, 2007 , cap. 15 ("Datos prácticos de laboratorio"), pág. 17 .
- (en) R. Swift y D. Davidson , " Resaca de alcohol: mecanismos y mediadores " , Alcohol Health Res. W. , vol. 22, n o 1,1998, p. 54-60 ( leer en línea ).
- (en) L. Hipolito , J. Sanchez et al. , “ Metabolismo cerebral del etanol y el alcoholismo: una actualización ” , Curr. Drug Metab , vol. 8, n o 7,octubre de 2007, p. 716-727 ( ISSN 1389-2002 , PMID 17979660 , DOI 10.2174 / 138920007782109797 ).
- (pdf) Ficha toxicológica N ° 120 de INRS, consultada el 24 de junio de 2017
- Juan I. Garaycoechea & al. (2018) El alcohol y los aldehídos endógenos dañan los cromosomas y mutan las células madre | Nature | doi: 10.1038 / nature25154 | publicado en línea el 3 de enero de 2018 | resumen
- (en) L. Kurti y B. Czako , Aplicaciones estratégicas de reacciones nombradas en síntesis orgánica , Academic Press ,2005, 864 p. ( ISBN 978-0-12-369483-6 , presentación en línea ) , pág. 264-265.
- GS Serullas , “ Hid yoduro de carbono. Circunstancias particulares en las que se produjo esta triple combinación; medios para producirlo instantáneamente ”, Annal. Chim. Phys. , vol. 20,Mayo de 1822, p. 17-37 ( leer en línea ).
- " El último cambio de superetanol E85..N645843 " , en usinenouvelle.com .
- (En) G. McDonnell y AD Russell , " Antisépticos y desinfectantes: actividad, acción y resistencia " , Clin. Microbiol. Rvdo. , vol. 12, n o 1,1999, p. 147–179 ( ISSN 0893-8512 , PMCID PMC88911 , leer en línea [PDF] ).
- (en) DG Barceloux , GR Bond et al. , “ Directrices de práctica de la Academia Estadounidense de Toxicología Clínica sobre el tratamiento de la intoxicación por metanol ” , Clin. Toxicol. , vol. 40, n o 4,2002, p. 415-446 ( DOI 10.1081 / CLT-120006745 ).
- (en) YB Shvets , estación de Washington: Mi vida como espía de la KGB en Estados Unidos , Nueva York, Simon & Schuster ,1995, 298 p. ( ISBN 978-0-671-88397-3 ).
- (in) " V2 " on Rocket and Space Technology (consultado el 27 de mayo de 2012 ) .
- (en) " propulsores de cohetes " , en La Enciclopedia de Internet de la Ciencia (visitada 27 de de mayo de 2012 ) .
- (in) " A Brief History of Rocketry " en el Centro Espacial Kennedy (consultado el 27 de mayo de 2012 ) .
- (en) LA Pohorecky y J. ladrillo , " Farmacología de etanol " , Pharmacol. El r. , vol. 36, n hueso 2-3,1988, p. 335–427 ( ISSN 0163-7258 , PMID 3279433 , DOI 10.1016 / 0163-7258 (88) 90109-X ).
- (in) " Ethanolum anhydricum " en la Dirección Europea de Calidad de los Medicamentos (consultado el 28 de mayo de 2012 ) .
- (en) DJ Nutt , THE King et al. , “ Daños por drogas en el Reino Unido: un análisis de decisiones multicriterio ” , Lancet , vol. 376, n o 9752,6 de noviembre de 2010, p. 1558-1565 ( ISSN 0140-6736 , DOI 10.1016 / S0140-6736 (10) 61462-6 ).
- (en) DA Yost , “ El cuidado agudo de intoxicación por alcohol. Esté preparado para considerar dilemas clínicos ” , Postgrad Med. , vol. 112, n o 6,2002, p. 14-26 ( ISSN 0032-5481 , PMID 12510444 , DOI 10.3810 / pgm.2002.12.1361 ).
- (en) V. Santhakumar , Mr. Wallner et al. , " El etanol actúa directamente sobre los subtipos extrasinápticos de los receptores GABA A para aumentar la inhibición tónica " , Alcohol , vol. 41, n o 3,Mayo de 2007, p. 211–221 ( ISSN 0741-8329 , PMID 17591544 , PMCID PMC2040048 , DOI 10.1016 / j.alcohol.2007.04.011 , leer en línea ).
- Virgolini, MB, Mattalloni, MS, Deza-Ponzio, R., Albrecht, PA y Cancela, LM (2019). Exposición al plomo e ingesta de etanol: estrés oxidativo como mecanismo de acción convergente . En neurociencia del alcohol (págs. 515-525). Prensa académica ( resumen ).
- (en) Fein G, D Greenstein, Cardenas VA, Cuzen NL, Stein DJ et al. , “ Volúmenes corticales y subcorticales en adolescentes con dependencia de alcohol pero sin sustancias o comorbilidades psiquiátricas ” , Psychiatry Res , vol. 214, n o 1,2013, p. 1-8. ( PMID 23916536 , PMCID PMC4203651 , DOI 10.1016 / j.pscychresns.2013.06.001 , leer en línea [html] )
- (en) Little G, P Maurage, Kornreich C Verbanck P, S Campanella, " El consumo excesivo de alcohol en adolescentes: una revisión de la investigación neurofisiológica y de neuroimagen " , Alcohol Alcohol , vol. 49, n o 22014, p. 198-206. ( PMID 24302160 , DOI 10.1093 / alcalc / agt172 , leer en línea [html] )
- (en) K. Nakamura , K. Iwahashi et al. , “ Aductos de acetaldehído en el cerebro de los alcohólicos ” , Arch. Toxicol. , vol. 77, n o 10,2003, p. 591-593 ( ISSN 0340-5761 , DOI 10.1007 / s00204-003-0465-8 ).
Ver también
Bibliografía
- (en) JE Logsdon , Enciclopedia de tecnología química Kirk-Othmer , John Wiley & Sons ,2004( ISBN 978-0-471-23896-6 , DOI 10.1002 / 0471238961.0520080112150719.a01.pub2 , leer en línea ) , "Etanol".
- (en) LA Pohorecky y J. Brick , “ Farmacología del etanol ” , Pharmacol. El r. , vol. 36, n hueso 2-3,1988, p. 335–427 ( ISSN 0163-7258 , PMID 3279433 , DOI 10.1016 / 0163-7258 (88) 90109-X ).
Artículos relacionados
- Otros alcoholes: alcohol , alcohol primario , metanol , propanol y butanol
- Cualidades: alcohol absoluto , alcoholes metilados , alcohol desnaturalizado y alcohol rectificado
- Producción: Fermentación alcohólica , Etanol de celulosa
- Uso: alcohol , bioetanol , bebida alcohólica , bebida espirituosa , industria del alcohol
- Historia: Historia de la cerveza , Historia de la vid y el vino.
- Propiedades fisiológicas: El alcohol deshidrogenasa , alcoholemia , el alcoholismo , la resaca , la intoxicación por alcohol , síndrome de alcoholismo fetal
- Varios: Cálculo de los títulos de alcohol y volúmenes , nivel de alcohol , lágrimas de vino , maceración alcohólica










