Helio
| Helio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Helio líquido superfluido ( T ≤ 2 K ). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Posición en la tabla periódica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Símbolo | Oye | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| apellido | Helio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número atómico | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo | 18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Período | 1 e período | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cuadra | Bloque s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Familia de elementos | gas noble | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | 1 s 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel de energía | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas del elemento. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atomica | 4,002602 ± 0,000002 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 128 pm ( 31 pm ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 28 p. M. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de Van der Waals | 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado de oxidación | 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óxido | desconocido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energías de ionización | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 re : 24.587387 eV | 2 e : 54,417760 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas corporales simples | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Gas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
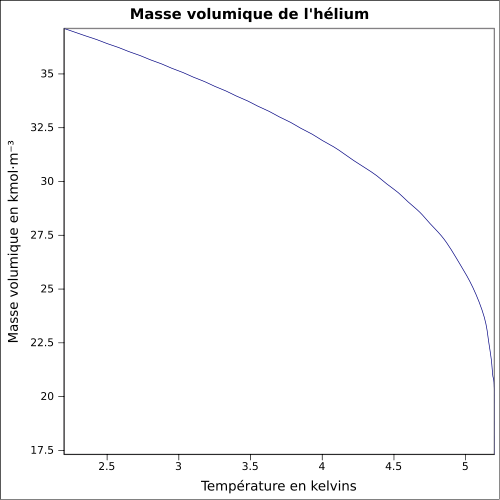
| Densidad |
0,1786 g · L -1 ( 0 ° C , 1 atm ); 0,125 kg · L -1 (líquido, -268,93 ° C ) ecuación:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sistema de cristal | Hexagonal compacto | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Color | Incoloro | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 0,95 K ( 26 atmósferas ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | −268,93 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energía de fusión | 5,23 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energía de vaporización | 0,08 kJ · mol -1 ( 1 atm , -268,93 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura crítica | −267,96 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión crítica | 2,26 atm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volumen molar | 22.414 × 10 -3 m 3 · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor |
ecuación:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 972 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor masivo | Cp 20,79 J · mol -1 · K -1
ecuación:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 152,0 mW · m -1 · K -1 ( 26,85 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diverso | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100,028,334 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CE | 231-168-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Precauciones | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Atención H280 y P410 + P403 H280 : Contiene gas a presión; puede explotar si se calienta P410 + P403 : Proteger de la luz solar. Almacenar en un área bien ventilada. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 A, A : Temperatura crítica del gas comprimido = −267,9 ° C Divulgación al 1,0% según los criterios de clasificación |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transporte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1046 : HELIO COMPRIMIDO Clase: 2.2 Etiqueta: 2.2 :Gasesno inflamables, no tóxicos (corresponde a los grupos designados por una A o una O mayúscula);  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unidades de SI y STP a menos que se indique lo contrario. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El helio es el elemento químico del número atómico 2 del símbolo He. Es un gas noble (o gas raro), prácticamente inerte , el primero del gas noble de la familia en la tabla periódica de los elementos . Su punto de ebullición es el más bajo entre los cuerpos conocidos, y solo existe en forma sólida cuando se somete a una presión superior a 25 atmósferas .
El helio tiene dos isótopos estables: helio 4 ( 4 He), el más abundante, y helio 3 ( 3 He). Estos dos isótopos, a diferencia de los de la mayoría de los elementos químicos, difieren notablemente en sus propiedades porque la proporción de sus masas atómicas es importante. Por otro lado, los efectos cuánticos, sensibles a bajas energías, les confieren propiedades muy diferentes. Este artículo trata principalmente del helio 4 ( 4 He). El artículo de Helium 3 recopila las propiedades específicas del isótopo 3 He.
La palabra helio se construyó a partir del griego Helios ( Ἥλιος / Hếlios , "el Sol " ), habiéndose observado este elemento por primera vez en el espectro solar en18 de agosto de 1868, durante un eclipse solar total , por el astrónomo Jules Janssen .
El helio es, después del hidrógeno , el elemento más abundante del Universo . La mayor parte de este helio se produjo durante la nucleosíntesis primordial, pero otros procesos lo producen, en particular la radiactividad α ( véase la subsección Abundancia natural ). En la Tierra , según una estimación de la Oficina de Gestión de Tierras de los Estados Unidos en 2006, los recursos de helio suman 52 mil millones de metros cúbicos.
El helio tiene varios usos en un fuerte crecimiento, mientras que la producción industrial ha disminuido por razones económicas: su escasez se está volviendo preocupante. Sin embargo, en 2016, desde el punto de vista económico, el mercado del helio está tranquilo y recientemente ha pasado de escasez a superávit.
Se conocen ocho isótopos de helio. El helio 3 (dos protones y un neutrón) y el helio-4 (dos protones y dos neutrones) son estables, otros son extremadamente inestables, existiendo prácticamente con certeza sólo durante su entrenamiento. En la atmósfera de la Tierra, solo hay un átomo de helio-3 por cada millón de átomos de helio-4 . A diferencia de la mayoría de los elementos, la abundancia isotópica de helio varía mucho según su origen, debido a los diferentes procesos de formación. El isótopo más abundante, el helio 4 , se produce en la Tierra por la radiactividad α de los elementos pesados: las partículas α producidas allí son núcleos de helio 4 completamente ionizados. El helio-4 es un núcleo de la estabilidad inusual porque sus nucleones están dispuestos en capas completas .
En todo el Universo, la mayor parte del helio presente se formó (en cantidades enormes, alrededor del 25% de toda la materia) durante la nucleosíntesis primordial . Casi todo el resto del helio producido en el Universo es (o ha sido) durante la nucleosíntesis estelar.
El helio-3 está presente en la Tierra solo en pequeñas cantidades; la mayoría datan de la formación de la Tierra, aunque todavía cae un poco sobre ella, atrapada en el polvo interestelar . También se siguen produciendo trazas por la radiactividad β del tritio . Las rocas en la corteza terrestre tienen proporciones isotópicas que varían hasta un factor de 10 y estas proporciones se pueden utilizar para determinar el origen de las rocas y la composición del manto de la Tierra. El helio-3 es más abundante en las estrellas, pero se produce durante la fusión nuclear , las estrellas no liberan muy poco (como deuterio y litio , o boro ) ya que n 'aparece solo en una cadena intermedia que conduce al helio 4 : se "consume" como se produce en las estrellas. Como resultado, en el medio interestelar , la proporción de isótopos es aproximadamente 100 veces mayor que en la Tierra. Los materiales extraplanetarios, como el regolito de la Luna o los asteroides, tienen rastros de helio 3 del viento solar . La superficie de la Luna contiene una concentración del orden de 10 -8 . Varios autores, comenzando con Gerald Kulcinski en 1986, han propuesto explorar la luna, extraer helio-3 del regolito y usarlo para generar energía a través de la fusión nuclear.
El helio-4 se puede enfriar hasta aproximadamente 1 K por evaporación. El helio-3 , que tiene un punto de ebullición más bajo, se puede enfriar a 0,2 K por el mismo método. Las mezclas de partes iguales de helio 3 y 4 se separan, por debajo de 0,8 K , porque ya no son miscibles , debido a sus diferencias (el átomo de helio 4 es un bosón mientras que el átomo de helio 3 es un fermión , siguen dos estadísticas cuánticas diferentes) . Los refrigeradores de dilución utilizan esta propiedad para lograr algunos milikelvins.
Se pueden producir otros isótopos de helio mediante reacciones nucleares , que son inestables y se desintegran rápidamente en otros núcleos. El isótopo con la vida media más corta es el helio 2 (2 protones, sin neutrones: el diprotón , que se descompone en dos protones en 3 × 10 −27 s ). El helio 5 y el helio 7 se desintegran por emisión de un neutrón con una vida media de 7,6 × 10 -23 sy 2,9 × 10 -21 s , respectivamente. El helio 6 y el helio 8 se desintegran por radiactividad β con una vida media de 0,8 sy 0,119 s , respectivamente. Los isótopos 6 y 8 tienen una estructura suelta en la que los neutrones que orbitan lejos del corazón, se llama halo nuclear .
El cuerpo de helio único
El helio es un gas incoloro, inodoro y no tóxico. Es prácticamente químicamente inerte , monoatómico en todas las circunstancias. En un amplio rango de temperaturas y presiones, se comporta experimentalmente como un gas ideal, lo que lo convierte en una sustancia privilegiada para la experimentación de teorías fisicoquímicas. Los dos isótopos estables del helio son los únicos compuestos químicos que no tienen un punto triple .
Gas
La conductividad térmica del gas helio es mayor que la de todos los gases excepto el hidrógeno, y su calor específico es excepcionalmente alto. Su coeficiente de Joule-Thomson es negativo a temperatura ambiente, lo que significa que, a diferencia de la mayoría de los gases, se calienta cuando puede relajarse libremente. La temperatura de inversión de Joule-Thomson es de unos 40 K o −233,15 ° C a una presión de 1 atm . Una vez enfriado por debajo de esta temperatura, el helio puede licuarse enfriando debido a su expansión.
El helio es también el gas menos soluble en agua de todos los gases conocidos. Debido al pequeño tamaño de sus átomos, su tasa de difusión a través de los sólidos es tres veces mayor que la del aire y aproximadamente un 65% la del hidrógeno.
El índice de refracción del helio está más cerca de la unidad que el de cualquier otro gas. La velocidad del sonido en el helio es mayor que la de cualquier otro gas excepto el hidrógeno.
A diferencia del plasma , el gas es un excelente aislante eléctrico.
Plasma
La mayor parte del helio extraterrestre se encuentra en estado de plasma , cuyas propiedades difieren notablemente de las del helio atómico. En el plasma, los electrones del helio no están unidos al núcleo, lo que conduce a una conductividad eléctrica muy alta, incluso cuando la ionización es parcial. Las partículas cargadas son muy sensibles a los campos eléctricos y magnéticos. Por ejemplo, en el viento solar , el helio ionizado y el hidrógeno interactúan con la magnetosfera de la Tierra, dando lugar a los fenómenos de las corrientes de Birkeland y la aurora polar .
Como otros gases nobles, el helio tiene niveles de energía metaestable que le permiten mantenerse excitado en una descarga eléctrica cuyo voltaje está por debajo de su potencial de ionización. Esto permite su uso en lámparas de descarga .
Líquido
A diferencia de otros elementos, el helio permanece líquido hasta el cero absoluto , a presiones por debajo de 25 atm . Esta es una consecuencia directa de la mecánica cuántica: más precisamente, la energía de los átomos en el estado fundamental del sistema es demasiado alta para permitir la solidificación (ver subcapítulo #Sólido ).
Por debajo de la temperatura de ebullición a 4,22 K y por encima del elemento lambda a 2,176 8 K , el helio-4 existe como un líquido incoloro normal de llamada helio I . Como otros líquidos criogénicos , hierve cuando se calienta y se contrae cuando se baja su temperatura. El helio I tiene un índice de refracción cercano al del gas: 1.026; lo que hace que su superficie sea tan difícil de ver que a menudo usamos flotadores de espuma de poliestireno para ver su nivel. Este líquido incoloro tiene una viscosidad muy baja y una densidad de 0,125 = 1/8 , que es solo una cuarta parte del valor predicho por la física clásica . Hay que recurrir a la mecánica cuántica para explicar esta propiedad y, por lo tanto, el helio líquido en sus diversas formas se denomina fluido cuántico , lo que significa que los efectos de la mecánica cuántica, normalmente sensible solo a escala microscópica, se manifiestan a escala macroscópica porque el helio el átomo 4 es un bosón . Esto se interpreta como una consecuencia del hecho de que el punto de ebullición está tan cerca del cero absoluto que los movimientos térmicos aleatorios ya no pueden enmascarar las propiedades atómicas.
Superfluido
El helio líquido por debajo del punto lambda comienza a exhibir características bastante inusuales, en un estado llamado helio II .
En la transición de helio I a helio II en el punto lambda, el helio se expande. A medida que desciende la temperatura, el helio II continúa expandiéndose, hasta aproximadamente 1 K , donde comienza a contraerse nuevamente como la mayoría de los cuerpos.
El helio II puede fluir a través de capilares de 10 -7 a 10 -8 m sin viscosidad medible. Sin embargo, cuando medimos la viscosidad entre dos discos que giran entre sí, encontramos una viscosidad comparable a la del helio gaseoso. La teoría actual explica este hecho utilizando un modelo de dos fluidos de László Tisza (in) para helio II . En este modelo, el helio líquido, por debajo del punto lambda, consiste en una mezcla de átomos de helio en estado fundamental y átomos en estados excitados, que se comportan más como un fluido ordinario.
Una ilustración de esta teoría viene dada por el efecto fuente . En este experimento, un tubo vertical, que tiene una pequeña boquilla en su extremo superior, se sumerge en su extremo inferior en un baño de helio II . Allí está bloqueado por un disco sinterizado , a través del cual solo puede circular el fluido sin viscosidad. Si calentamos el tubo, encendiéndolo por ejemplo, transformaremos la parte superfluida en fluido ordinario. Para restablecer el equilibrio de los dos fluidos con el baño, el superfluido penetrará por el tapón sinterizado, y para conservar el volumen, parte del contenido del tubo será expulsado por la boquilla superior, formando un chorro que puede interrumpir dejando de calentar.
La conductividad térmica del helio II es mayor que la de cualquier otro cuerpo conocido. Esto evita que el helio II hierva, ya que cualquier entrada de calor viaja inmediatamente a la superficie, donde simplemente se evapora en gas. Esta conductividad es un millón de veces mayor que la del helio I y varios cientos de veces la del cobre. Esto se debe al hecho de que la conducción de calor se realiza mediante un mecanismo cuántico excepcional. La mayoría de los materiales que son buenos conductores de calor tienen una banda de valencia de electrones libres que se utilizan para conducir el calor. El Helium II no tiene tal cinta y aún conduce bien el calor. El flujo de calor obedece a ecuaciones similares a las ecuaciones de onda para la propagación del sonido en el aire. Cuando se introduce calor, viaja a 20 m s −1 a 1.8 K en helio II . Estas ondas se denominan segundo sonido .
A diferencia de los líquidos ordinarios, el helio II se arrastra por las superficies, incluso, aparentemente, contra la gravedad . Se escapará de un recipiente abierto arrastrándose hacia los lados, a menos que encuentre un lugar menos frío donde se evapora. Cualquiera que sea la superficie, se mueve en una película de unos 30 nm . Esta película se llama película de Rollin , en memoria del físico que la caracterizó por primera vez, Bernard V. Rollin. Como resultado de este efecto y la capacidad del helio II para pasar rápidamente a través de pequeñas aberturas, es difícil confinar el helio líquido. A menos que el recipiente esté construido inteligentemente, el helio II trepará por las paredes y pasará a través de las válvulas hasta llegar a una región más cálida donde se evaporará. Las ondas que se propagan a lo largo de una película de Rollins siguen las mismas ecuaciones que las ondas en aguas poco profundas, pero la fuerza restauradora aquí es la fuerza de van der Waals en lugar de la gravedad. Estas ondas se conocen como el tercer sonido .
Sólido
El helio se solidifica solo bajo el efecto de fuertes presiones. El sólido resultante prácticamente invisible e incoloro es altamente comprimible; La compresión de laboratorio puede reducir su volumen en más del 30%. Con un módulo de elasticidad cúbico del orden de 5 × 10 7 Pa , es cincuenta veces más compresible que el agua. En condiciones normales de presión, ya diferencia de otros elementos, el helio no se solidifica y permanece líquido hasta el cero absoluto . El helio sólido requiere una presión mínima de aproximadamente 26 atm . A menudo es bastante difícil distinguir el helio sólido del helio líquido, ya que sus índices de refracción son casi idénticos. El sólido tiene un alto calor latente (calor de fusión) y una estructura cristalina hexagonal, como la del agua.
Propiedades químicas
Como todos los gases nobles , el helio tiene su capa de valencia completa , lo que implica una reactividad química muy baja. Dado que no tiene subcapas capaces de reaccionar, es (junto con el neón ) el menos reactivo de todos los cuerpos simples .
Sin embargo, el helio puede formar compuestos inestables ( excímeros ) con tungsteno, yodo, flúor, azufre y fósforo en la fase plasmática , por descarga o de otro modo. He Ne , Hg He 10 , W He 2 y los iones moleculares He 2 + , He 2 ++ , HeH + , He D + se crearon de esta manera. Esta técnica también ha permitido la producción de la molécula neutra He 2 , que tiene un mayor número de sistemas de bandas, y HgHe, cuya cohesión parece depender únicamente de las fuerzas de polarización . En teoría, también son posibles otros componentes como el fluorohidruro de helio (HHe F ). En 2013, el heliuro de litio LiHe se formó en estado gaseoso mediante ablación con láser a muy baja temperatura ( 1 a 5 K ).
Los primeros compuestos de helio estables probados son los complejos de fullereno endoédrico , como He @ C 60 , donde un átomo de helio está atrapado en una jaula de fullereno C 60 . Desde entonces, se ha demostrado que a muy alta presión (superior a 113 GPa ) es posible formar un compuesto estable de helio y sodio, Na 2 He . Estas moléculas también podrían encontrarse en planetas gigantes de alta presión como Júpiter y Saturno .
Del interior de la Tierra emerge (en lavas y gases volcánicos ) helio rico en helio 3 , que se cree que es primordial (es decir, adquirido durante la formación de la Tierra , hace casi 4.600 millones de años ). Si estuviera en estado gaseoso o disuelto en los minerales del manto inferior, habría tenido tiempo suficiente para desgasificarse casi por completo, dada su volatilidad y las temperaturas dentro de la Tierra. Por lo tanto, debe almacenarse como un mineral estable en las condiciones del manto inferior , pero no se conoce ninguno. El cálculo de 2018 de la entalpía libre de mil compuestos de helio hipotéticos pero plausibles predijo un (y solo uno) compuesto de entalpía libre lo suficientemente pequeño como para atrapar el helio en el manto en lugar de dejarlo. Libre, dióxido de hierro y helio FeO 2 He.
Propiedades biologicas
El helio, neutro en condiciones estándar, no es tóxico, no desempeña ningún papel biológico y se encuentra en pequeñas cantidades en la sangre humana. Si se inhala lo suficiente como para desplazar el oxígeno necesario para la respiración normal, es posible la asfixia .
Inhalación
| Archivo de audio | |
| Texto leído con helio | |
| Si es necesario, use la tecla de página anterior del navegador al final de la audiencia . (es) El helio es un elemento químico monoatómico inerte, incoloro, inodoro, insípido, atóxico, que encabeza la serie de gases nobles en la tabla periódica y cuyo número atómico es 2. Sus puntos de ebullición y fusión son los más bajos entre los elementos y existe solo como gas, excepto en condiciones extremas . | |
| ¿Dificultad para utilizar estos medios? | |
|---|---|
La voz de un individuo que ha inhalado helio cambia temporalmente de tono hacia armónicos altos - el helio es tres veces menos denso que el aire, la velocidad del sonido se vuelve más alta - y como la frecuencia fundamental d 'una cavidad llena de gas es proporcional a la velocidad del sonido, la inhalación de helio corresponderá a un aumento de las frecuencias de resonancia del aparato fonatorio que modula la frecuencia fundamental dada por las cuerdas vocales . Se puede obtener un efecto opuesto, bajar el timbre, inhalando un gas más denso, como el hexafluoruro de azufre .
La inhalación de helio puro en dosis bajas normalmente es segura, ya que es un gas inerte . Sin embargo, el uso de helio que se vende en el comercio, como el que se usa para inflar globos, puede ser peligroso debido a la gran cantidad de contaminantes que puede contener, trazas de otros gases o aerosoles de aceite lubricante.
Inhalar helio en exceso puede ser peligroso, ya que el helio es simplemente un asfixiante , que reemplaza el oxígeno requerido para la respiración normal. Respirar helio puro provoca asfixia en cuestión de minutos. Inhalar helio directamente de cilindros presurizados es extremadamente peligroso, debido a la alta tasa de flujo, que puede producir un barotrauma que desgarra el tejido pulmonar y puede ser fatal. Sin embargo, este accidente es bastante raro, ya que solo hubo dos muertes entre 2000 y 2004 en los Estados Unidos.
A alta presión (más de 20 atm o 2 MPa ), una mezcla de helio y dioxígeno ( heliox ) puede provocar el síndrome nervioso de alta presión , una especie de efecto contra-anestésico. Añadiendo un poco de nitrógeno a la mezcla, se puede evitar el problema. Sin embargo, en el buceo subacuático, el síndrome nervioso de alta presión solo puede contrarrestarse mediante la adición de hidrógeno , siendo la adición de nitrógeno altamente narcótica en cuanto la presión total alcanza los 5 bares.
Uso terapéutico
El helio se administra en mezclas que contienen un mínimo de 20% de dioxígeno a pacientes con obstrucción de las vías respiratorias superiores o inferiores. La baja viscosidad del helio permite así reducir el trabajo respiratorio.
seguridad
Las medidas de seguridad para el helio criogénico son similares a las requeridas para el nitrógeno líquido ; su temperatura extremadamente baja puede provocar quemaduras por frío.
La inhalación de una gran cantidad en una toma produce una leve asfixia , lo que lleva a una breve pero peligrosa pérdida del conocimiento . También hay algunos casos de embolia cerebral o problemas pulmonares graves en personas que inhalan helio presurizado.
Además, la velocidad de expansión entre la fase líquida y la fase gaseosa es tal que puede provocar explosiones en caso de vaporización rápida, si no se instala ningún dispositivo limitador de presión.
Los depósitos de helio gaseoso a 5 - 10 K también deben manipularse como si contuvieran helio líquido, debido a la gran y rápida expansión térmica que tiene lugar cuando se introduce helio por debajo de 10 K. a temperatura ambiente.
Usos
A pesar de su alto precio, el helio se utiliza para muchos usos que requieren algunas de sus propiedades únicas, como su bajo punto de ebullición , baja densidad , baja solubilidad , alta conductividad térmica o su carácter química y biológicamente inerte . Se encuentra comercialmente en forma líquida o gaseosa. En forma líquida, se pueden encontrar pequeños tanques llamados dewars , que pueden contener hasta 1000 l de helio, o en grandes tanques ISO con capacidades nominales de hasta 40.000 l . En forma gaseosa, pequeñas cantidades de helio se suministran en cilindros de alta presión que contienen hasta 8,5 m 3 estándar, mientras que grandes cantidades se entregan en camiones cisterna presurizados que pueden tener capacidades de hasta 5.000 m 3 estándar.
Industrial
Debido a su inercia, su alta conductividad térmica , su transparencia a los neutrones y porque no forma isótopos radiactivos en los reactores, el helio se utiliza como fluido caloportador en ciertos reactores nucleares refrigerados por calor .
El helio se utiliza como atmósfera protectora durante el crecimiento del silicio monocristalino para la fabricación de circuitos integrados y fibras ópticas , para la producción de titanio y circonio , y en cromatografía de gases , porque es inerte.
Por su inercia química, sus ideales propiedades termodinámicas y caloríficas , su alta velocidad de sonido y un gran coeficiente de Laplace , también es útil en túneles de viento supersónicos o para instalaciones que estudian fenómenos transitorios.
Estas mismas propiedades permiten su uso en discos duros sellados para aumentar su capacidad. Como ningún sello es perfecto, estos discos tienen un detector que señala cualquier pérdida de helio que sea peligrosa para el disco con el tiempo.
El helio mezclado con un gas más pesado, como el xenón, es útil para la refrigeración termoacústica , debido a la gran proporción de capacidades térmicas y al bajo número de Prandtl . La inercia química del helio tiene beneficios ambientales sobre otros sistemas de refrigeración, que contribuyen al agujero de ozono o al calentamiento global .
Dado que se difunde a través de los sólidos tres veces más rápido que el aire, el helio se utiliza para detectar fugas en equipos de vacío ultra alto o tanques de alta presión.
También se utiliza con productos alimenticios (aditivo alimentario autorizado por la Unión Europea bajo la referencia E939 ) para permitir comprobar el sellado de los envases (ver listado de aditivos alimentarios ).
Científicos
El uso de helio reduce los efectos de distorsión debidos a variaciones de temperatura en el espacio entre las lentes de ciertos telescopios o gafas , debido a su índice de refracción excepcionalmente bajo. Este método se utiliza especialmente para telescopios solares, sometidos a importantes variaciones de temperatura, pero para los que un recinto que soporta la diferencia de presión entre la atmósfera y el vacío sería demasiado pesado.
La edad de las rocas y minerales que contienen uranio y torio se puede estimar midiendo su contenido de helio mediante un proceso llamado datación por helio .
El helio líquido también se usa para enfriar ciertos metales a las temperaturas extremadamente bajas requeridas para la superconductividad , por ejemplo, para los imanes superconductores utilizados en particular para los detectores de resonancia magnética . El LHC en CERN utiliza 120 t de helio líquido para mantener la temperatura de los imanes a 1,9 K . De manera más general, el helio a baja temperatura se usa en criogenia .
Comercial y de ocio
Debido a su baja solubilidad en el tejido nervioso , las mezclas de helio como trimix , heliox y helio se utilizan para el buceo profundo para reducir los efectos de la narcosis por nitrógeno . A profundidades superiores a 150 m , se añaden pequeñas cantidades de hidrógeno a la mezcla de helio-dioxígeno para contrarrestar el síndrome nervioso de alta presión .
A estas profundidades, la baja densidad del helio reduce considerablemente el esfuerzo respiratorio.
Los láseres He-Ne tienen varias aplicaciones, especialmente lectores de códigos de barras .
Aeronaves, globos y cohetes
Dado que el helio es más liviano que el aire, se puede usar para inflar aeronaves y globos libres o atados. Aunque el hidrógeno tiene aproximadamente un 7% más de capacidad de carga, el helio tiene la ventaja de ser incombustible (e incluso retardante de llama).
La exploración de la atmósfera, en particular para la meteorología, se realiza con globos, la mayoría de las veces inflados con helio.
En la tecnología de cohetes, el helio se utiliza como medio de desplazamiento para gestionar el combustible y oxidante en tanques de microgravedad por presurización y para asegurar la mezcla de hidrógeno y oxígeno que alimenta las toberas de propulsión. También se utiliza para purgar estas sustancias de los equipos terrestres antes del lanzamiento y para preenfriar el hidrógeno líquido de los vehículos espaciales . Por ejemplo, el cohete Saturno V consumió alrededor de 370.000 m 3 de helio para despegar.
Recursos y purificación de helio
Abundancia natural
El helio es el segundo elemento más abundante del Universo conocido después del hidrógeno y constituye el 23% de su masa bariónica . La gran mayoría del helio se formó por nucleosíntesis primordial , pocos minutos después del Big Bang . Es por eso que la medición de su abundancia ayuda a fijar ciertos parámetros de los modelos cosmológicos. Durante la mayor parte de la existencia de estrellas , está formado por la fusión nuclear de hidrógeno. Al final de su vida, las estrellas utilizan el helio como materia prima para la creación de elementos más pesados, mediante procesos mucho más rápidos e incluso explosivos. En última instancia, el helio en el Universo proviene solo de una parte muy pequeña de las estrellas.
En la atmósfera de la Tierra, la concentración de helio es de 5,2 × 10 −6 en volumen. Esta baja concentración es bastante constante en el tiempo, debido a un equilibrio entre la producción continua de helio en las rocas y el escape al espacio por diversos mecanismos . En la heteroesfera terrestre, parte de la atmósfera superior, el helio y otros gases ligeros son los constituyentes más abundantes.
Casi todo el helio de la Tierra proviene de la radiactividad α . Se encuentra principalmente en compuestos de uranio y torio , como la pecblenda , la carnotita y la monacita , porque emiten partículas α , que son núcleos de helio ionizado He 2+ , que se neutralizan inmediatamente con electrones. Se estima que cada año se producen 3.000 t de helio en la litosfera . En la corteza terrestre, la concentración de helio es de 8 × 10 −6 en volumen. En agua de mar, es solo 4 × 10-12 . También hay pequeñas cantidades en agua mineral , gases volcánicos y hierro meteórico . Dado que el helio queda atrapado como el gas natural por capas de rocas impermeables, las concentraciones más altas de helio se encuentran en los campos de gas natural, de los cuales se extrae la mayor parte del helio comercial. Su concentración de volumen relativa al gas natural varía desde unas pocas partes por millón hasta una concentración del 7% identificada en el condado de San Juan, Nuevo México .
En 2016, una empresa llamada "Helium" dijo haber identificado tres posibles campos masivos de este elemento en Tanzania , lo suficientemente grandes -según ella- para abastecer al mundo durante varias décadas, por lo que busca 40 millones de dólares de inversión para intentar perforar en Tanzania en 2017. Sin embargo, algunos expertos creen que la explotación de este depósito no sería rentable durante mucho tiempo, porque según ellos el mercado mundial ha entrado recientemente en un período de sobreproducción debido a un uso más económico y en el mercado más grande en los Estados Unidos , Qatar y Rusia .
Extracción y purificación
Para un uso a gran escala, el helio se extrae mediante destilación fraccionada del gas natural, que puede contener hasta un 7%. Dado que el helio tiene un punto de ebullición más bajo que cualquier otro cuerpo, la baja temperatura y la alta presión se utilizan para licuar casi todos los demás gases (principalmente dinitrógeno y metano ). A continuación, el helio bruto resultante se purifica mediante exposición a temperaturas cada vez más bajas, lo que precipita prácticamente todo el nitrógeno y otros gases restantes de la mezcla de gases. Finalmente, se utiliza carbón activado para un paso de purificación final, para así obtener helio con una calidad del 99,995%. La principal impureza del helio de grado A es el neón . Para completar la purificación, la mayor parte del helio producido se licúa mediante un proceso criogénico. Licuefacción es necesaria para las aplicaciones que utilizan el helio líquido y, además, permite a los proveedores de helio para reducir el costo de transporte remoto, ya que los tanques de helio líquido más grandes tienen una capacidad de al menos cinco veces mayor que los más grandes. Remolques que llevan los cilindros de gas de helio a presión a .
En 2005, alrededor de 160 millones de metros cúbicos de helio se extrajeron del gas natural o de las reservas, con aproximadamente el 83% de Estados Unidos , el 11% de Argelia y el resto principalmente de Rusia y Polonia . En los Estados Unidos, la mayor parte del helio se extrae del gas natural en Hugoton y campos vecinos en Kansas, Oklahoma y Texas.
Otro método para producir y purificar helio es la difusión de gas natural crudo a través de membranas semipermeables u otras barreras.
Es posible sintetizar helio bombardeando litio o boro con protones de alta energía, pero este no es un método de producción económicamente viable.
Historia
Descubrimiento
La primera indicación de helio se observa en 18 de agosto de 1868Como una franja de color amarillo brillante a una longitud de onda de 587,49 nm en el espectro de la cromosfera del sol . Esta línea es detectada por el astrónomo francés Jules Janssen durante un eclipse total en Guntur (India) . Al principio, se cree que esta línea es la del sodio . La20 de octubredel mismo año, el astrónomo inglés Norman Lockyer observó una línea amarilla en el espectro solar, a la que denominó línea Fraunhofer D 3 , por su proximidad a las conocidas líneas D 1 y D 2 del sodio. Concluye que es causado por un elemento del Sol desconocido en la Tierra. Lockyer y el químico inglés Edward Frankland nombran este elemento después de la palabra griega para sol, ἥλιος ( helios ).
En 1882, Luigi Palmieri logró por primera vez demostrar la presencia de helio en la Tierra mediante el análisis espectral de la lava del Vesubio .
La 26 de marzo de 1895, El químico británico Sir William Ramsay aísla helio en la Tierra mediante el tratamiento de la kleveita (una variedad de pechblenda que contiene al menos un 10% de tierras raras ) con ácidos minerales. Ramsay estaba buscando argón , pero, después de separar el nitrógeno y el oxígeno del gas liberado por el ácido sulfúrico , notó una línea amarilla brillante en el espectroscopio que coincidía con la línea D 3 observada en el espectro solar.
Lockyer y el físico británico William Crookes identifican estas muestras como helio . Independientemente, es aislado de la cleveita el mismo año por los químicos Per Theodor Cleve y Abraham Langlet (en) en Uppsala , quienes acumulan suficiente gas para poder determinar con precisión su peso atómico .
El geoquímico estadounidense William Francis Hillebrand también había aislado helio , unos años antes del descubrimiento de Ramsay, al notar líneas espectrales inusuales al examinar una muestra de uaninita. Pero Hillebrand atribuye estas líneas al dinitrógeno. Su carta de felicitación a Ramsay presenta un caso interesante de descubrimiento y casi descubrimiento en la ciencia.
En 1907, Ernest Rutherford y Thomas Royds demostraron que las partículas α son núcleos de helio, al permitir que las partículas ingresen a través de una delgada ventana de vidrio de un tubo por donde se evacuan, y luego crear una descarga en el tubo para estudiar el espectro del nuevo gas en eso. En 1908, el helio fue licuado por primera vez por el físico holandés Heike Kamerlingh Onnes , enfriando el gas por debajo de 1 K . Intenta solidificarlo bajando más la temperatura, pero falla, ya que el helio no tiene un punto triple . Es un alumno de Onnes, Willem Hendrik Keesom , quien logra solidificar bajo presión 1 cm 3 de helio en 1926.
En 1938, el físico soviético Pyotr Leonidovich Kapitsa descubrió que el helio-4 casi no tenía viscosidad a temperaturas cercanas al cero absoluto, un fenómeno que ahora se llama superfluidez. En 1972, los físicos estadounidenses Douglas D. Osheroff , David M. Lee y Robert C. Richardson observaron el mismo fenómeno en el helio 3 , pero a una temperatura mucho más cercana al cero absoluto . El fenómeno del helio 3 se interpreta como la formación de pares de átomos, que son fermiones , para formar bosones , por analogía con los pares de electrones de Cooper en la base de la superconductividad .
Producción y usos
Después de una perforación petrolera en 1903 en Dexter , Kansas , el chorro de gas producido era incombustible. Erasmus Haworth (en) , el geólogo del estado de Kansas, recogió algunas muestras del gas producido y las llevó a la Universidad de Kansas , Lawrence . Con la ayuda de los químicos Hamilton Cady (en) y David McFarland, se determinó que el gas, por volumen, 72% nitroso, 15% metano (porcentaje combustible solo con más oxígeno) y 12% gas no identificable. Un análisis más detallado muestra a Cady y McFarland que el 1,84% de la muestra de gas es helio. Esto muestra que, a pesar de su escasez global en la Tierra, el helio se concentra en grandes cantidades en las Grandes Llanuras de Estados Unidos y está disponible para la producción como subproducto de la explotación de gas natural. Las mayores reservas de helio se encuentran en el campo Hugoton y en los campos vecinos en el suroeste de Kansas con extensiones a Texas y Oklahoma.
Esto permitió que Estados Unidos se convirtiera en el principal productor mundial de helio. Por sugerencia de Sir Richard Threlfall (en) , la Armada de los Estados Unidos subvenciona tres pequeñas plantas experimentales de producción de helio durante la Primera Guerra Mundial . El objetivo es suministrar a los globos de barrera atados este gas no inflamable que es más ligero que el aire. Este programa produce un total de 5.700 m 3 de 92% de helio, aunque anteriormente se habían producido menos de 100 L en total. Parte de este gas se utiliza para el primer dirigible lleno de helio del mundo, el C-7 de la Armada de los Estados Unidos, inaugurado en su viaje inaugural desde Hampton Roads en Virginia hasta Bolling Field en Washington el1 st de diciembre de 1.921.
Aunque el proceso de licuefacción de gas a baja temperatura no se desarrolló lo suficientemente temprano como para desempeñar un papel importante durante la Primera Guerra Mundial, la producción continuará. El helio se usa principalmente para inflar globos . Este uso aumentará la demanda durante la Segunda Guerra Mundial , al igual que la demanda de soldadura por arco .
El espectrómetro de masas de helio también es vital para el proyecto de la bomba atómica de Manhattan .
El gobierno de los Estados Unidos creó en 1925 una Reserva Nacional de Helio en Amarillo , Texas , con el objetivo de suministrar aerostatos, personal militar en tiempos de guerra y civiles en tiempos de paz. Debido al embargo militar de Estados Unidos contra Alemania, el suministro de helio allí fue restringido y el Hindenburg tuvo que ser inflado con hidrógeno, con las catastróficas consecuencias que sobrevinieron cuando se incendió. El consumo de helio después de la Segunda Guerra Mundial disminuyó, pero la reserva se incrementó en la década de 1950 para garantizar el suministro de helio líquido para el lanzamiento de cohetes durante la carrera espacial y la Guerra Fría . En 1965, el consumo de helio en Estados Unidos superó ocho veces el máximo que alcanzó durante la guerra.
Tras las Enmiendas a la Ley de Helio de 1960 (Ley Pública 86-777 ), la Oficina de Minas de los Estados Unidos estableció cinco fábricas privadas para extraer helio del gas natural. Para este programa de preservación de helio , la Oficina está construyendo un oleoducto de 684 km desde Bushton, Kansas , hasta Cliffside, cerca de Amarillo, un campo parcialmente agotado. La mezcla de helio-dinitrógeno así suministrada se inyecta y se almacena hasta el momento de la necesidad, cuando se extrae y se purifica.
En 1995 se recolectaron mil millones de metros cúbicos de gas pero la reserva tiene una deuda de 1.400 millones de dólares, lo que lleva al Congreso de los Estados Unidos , en 1996, a cesar gradualmente su actividad. La consiguiente Ley de Privatización del Helio de 1996 (Ley Pública 104-273) ordena al Departamento del Interior de los Estados Unidos comenzar a vaciar la reserva en 2005.
El helio producido entre 1930 y 1945 tenía una pureza del 98,3% (~ 2% de nitrógeno), lo que era ideal para aeróstatos. En 1945, se produjo una pequeña cantidad de helio al 99,9% para su uso en soldadura por arco. Ya en 1949, estaban disponibles cantidades comerciales de helio de grado A al 99,995%.
Durante varios años, Estados Unidos produjo más del 90% del helio disponible comercialmente en el mundo, y las plantas de extracción en Canadá, Polonia, Rusia y otras naciones produjeron el resto. A este ritmo, según un estudio (agosto 2010), las reservas de Estados Unidos se agotarán antes de 2040 (casi un tercio de las necesidades mundiales son suplidas por Estados Unidos cuya capacidad de producción global es de unos 142 millones de metros cúbicos (en 2010) mientras que el consumo ascendió a 180 millones de metros cúbicos y que el helio parece "esencial para la mayoría de sus aplicaciones" ).
A mediados de la década de 1990 , una nueva fábrica comenzó a producir en Arzew , Argelia . Con 1,7 × 10 7 m 3 al año, puede cubrir toda la demanda europea, o alrededor del 16% de la producción mundial. Mientras tanto, el consumo en los Estados Unidos superó las 15.000 t en 2000. En 2004-2006, se construyeron dos plantas adicionales, una en Ras Laffan ( Qatar ) que produce 9,2 toneladas de helio líquido por día, es decir, 1,88 × 10 7 m 3 por año. y el otro en Skikda (Argelia). Argelia se convirtió rápidamente en el segundo mayor productor de helio. Durante este período, el consumo de helio y los costos de producción aumentaron. Entre 2002 y 2007, los precios del helio se duplicaron y solo en 2008, los principales proveedores aumentaron sus precios en aproximadamente un 50% . Esto está vinculado a la muy baja producción y consumo de helio, lo que dificulta igualarlos, ya que pocos productores desean invertir en este “ nicho de mercado ”.
Robert Richardson ( Premio Nobel de Física ) en 2010 alertó a la comunidad internacional sobre el riesgo de escasez, defendiendo un aumento de precios, para reflejar la escasez de este elemento y desperdiciarlo menos .
La empresa 45-8 Energy, con sede en Metz , presentó en octubre de 2019 un permiso de exploración exclusivo de helio en el suroeste del departamento de Nièvre , en Francia. Se espera la respuesta de la prefectura en septiembre de 2020.
Notas y referencias
- (fr) Este artículo está tomado parcial o totalmente del artículo de Wikipedia en inglés titulado " Helium " ( ver la lista de autores ) .
- Estadísticas de Bose-Einstein y estadísticas de Fermi-Dirac .
- Vea un clip en Youtube por ucilowtemp .
- (en) David R. Lide, Manual CRC de Química y Física , CRC Press Inc,2009, 90 ª ed. , 2804 p. , Tapa dura ( ISBN 978-1-420-09084-0 )
- (in) Beatriz Cordero Verónica Gómez, Ana E. Platero-Prats, Marc Revés Jorge Echeverría, Eduard Cremades, Flavia y Santiago Barragan Alvarez , " Radios covalentes revisitados " , Dalton Transactions ,2008, p. 2832-2838 ( DOI 10.1039 / b801115j )
- "Energías de ionización de átomos e iones atómicos", en CRC Handbook of Chemistry and Physics, 91st Edition (Internet Version 2011), WM Haynes, ed., CRC Press / Taylor y Francis, Boca Raton, FL., P. 10-203
- (en) Robert H. Perry y Donald W. verde , de Perry Ingenieros Químicos Handbook , EE.UU., McGraw-Hill,1997, 7 ª ed. , 2400 p. ( ISBN 0-07-049841-5 ) , pág. 2-50
- "Helio" en las sustancias peligrosas Banco de datos , alcanzada el 1 de mayo de, 2010
- Consulta de la base de datos de Chemical Abstracts a través de SciFinder Web el 15 de diciembre de 2009 ( resultados de búsqueda )
- Sigma-Aldrich hoja del compuesto Helium ≥99.995% , consultado el 17 de agosto, 2.018 mil.
- " Helio " en la base de datos de productos químicos Reptox de la CSST (organización de Quebec responsable de la seguridad y salud en el trabajo), consultado el 25 de abril de 2009
- Paul Depovere, La tabla periódica de los elementos. La maravilla fundamental del Universo , De Boeck Supérieur ,2002, p. 103.
-
(en) Eric Hand, “ campos de helio masivas encuentran en zona de la grieta de Tanzania ” , Ciencia , vol. 353, n o 6295,8 de julio de 2016, p. 109-110 ( DOI 10.1126 / science.353.6295.109 , leído en línea
 , consultado el 11 de julio de 2016 ).
, consultado el 11 de julio de 2016 ).
- Audrey Chauvet, "Las reservas mundiales de helio se están desinflando " , en www.20minutes.fr ,30 de agosto de 2010(consultado el 22 de junio de 2019 ) .
- (en) John Emsley , Nature's building blocks: an AZ guide to the elements , Oxford New York, Oxford University Press ,2001, 538 p. ( ISBN 978-0-19-850340-8 y 978-0-198-50341-5 , OCLC 248877093 , leer en línea ) , pág. 175-179.
-
(en) Achim Weiss, " Elementos del pasado: Nucleosíntesis y observación del Big Bang " , Instituto Max Planck de Física Gravitacional (consultado el 23 de junio de 2009 ) ;.
(en) A. Coc et al. , “ Nucleosíntesis de Big Bang actualizada confrontada con observaciones de WMAP y con la abundancia de elementos de luz ” , The Astrophysical Journal , vol. 600,2004, p. 544 ( DOI 10.1086 / 380121 ). -
(en) Don L. Anderson, GR Foulger Anders Meibom, " helio Fundamentals " , MantlePlumes.orgMantlePlumes.org,
2006(consultado el 20 de julio de 2008 ) .
Solo
resumen. Artículo ofrecido a la venta. - (en) Aaron Novick , " Half-Life of Tritium " , Physical Review , vol. 72, 1947, p. 972 ( DOI 10.1103 / PhysRev.72.972.2 , leer en línea )Acceso restringido a suscriptores de PROLA.
- (en) GN Zastenker y E. Salerno, F. Buehler, P. Bochsler, M. Bassi, YN Agafonov, NA Eismont, VV Khrapchenkov, H. Busemann , " Composición isotópica y abundancia de helio neutro interestelar basado en mediciones directas " , Astrofísica , vol. 45, n o 2Abril de 2002, p. 131–142 ( DOI 10.1023 / A: 1016057812964 , leer en línea ) Solo resumen . Artículo ofrecido a la venta.
- (en) " Minería Lunar de Helio-3 " , Instituto de Tecnología de Fusión de la Universidad de Wisconsin-Madison, 2007(consultado el 9 de julio de 2008 ) .
- (en) EN Slyuta AM Abdrakhimov EM Galimov, " La estimación de las reservas probables de helio-3 en el regolito lunar en la ciencia lunar y planetaria XXXVIII " [PDF] ,2007(consultado el 23 de junio de 2009 ) .
- (en) Eric R. Hedman , " Una hora fascinante con Gerald Kulcinski " , The Space Review ,16 de enero de 2006( leer en línea ).
- (en) Peter Häussinger1 Reinhard Glatthaar2 Wilhelm Rhode3 Helmut Kick4 Christian Benkmann5 Josef Weber6 Hans-Jörg Wunschel7 Viktor Stenke8 Edith Leicht9 Hermann Stenger10, Noble gas , Wiley-VCH Verlag GmbH & Co , et al. " Enciclopedia de química industrial de Ullmann ",15 de marzo de 2001( presentación en línea ).
- (en) LW Brandt, (Clifford A. Hampel, ed.) La enciclopedia de los elementos químicos , Reinhold Book Corporation , Nueva York, 1968, cap. "Helio" , pág. 256–268 .
- (en) Ray F. Weiss , " Solubilidad de helio y neón en agua y agua de mar " , J. Chem. Ing. Datos , vol. 16, n o 21971, p. 235–241 ( DOI 10.1021 / je60049a019 )Primera página.
- (en) Jack A. Stone y Alois Stejskal , " Usando helio como patrón de refracción " , Metrologia , vol. 41,2004, p. 189–197 ( DOI 10.1088 / 0026-1394 / 41/3/012 ) Resumen .
- (en) La enciclopedia de los elementos químicos , op. cit. , p. 261 .
- (en) F. Buhler y WI Axford, HJA Chivers, K. Martin , " Isótopos de helio en el año aurora " , J. Geophys. Res. , vol. 81, n o 1,1976, p. 111-115 ( DOI 10.1029 / JA081i001p00111 ) Resumen .
- (en) La Enciclopedia de los elementos químicos , op. cit. pag. 262 .
- (en) PC Hohenberg y PC Martin , " Teoría microscópica del helio superfluido " , Annals of Physics , vol. 281, n hueso 1-2,Octubre de 2000, p. 636–705 ( DOI 10.1006 / aphy.2000.6019 ) Resumen . Artículo disponible para suscriptores de ScienceDirect.
- (en) La Enciclopedia de los elementos químicos , op. cit. , p. 263 .
- (En) HA Fairbank y CT Lane , " Tasas de película de Rollin en helio líquido " , Physical Review , vol. 76, n o 8,Octubre de 1949, p. 1209–1211 ( DOI 10.1103 / PhysRev.76.1209 ) Resumen . Artículo ofrecido a la venta.
- (in) BV Rollin y F. Simon , " Sobre el fenómeno de la" película "del helio líquido II " , Physica , vol. 6, n o 21939, p. 219–230 ( DOI 10.1016 / S0031-8914 (39) 80013-1 ) Resumen . Artículo disponible para suscriptores de ScienceDirect.
- (en) Fred Ellis, " Third sound " , Wesleyan Quantum Fluids Laboratory ,Septiembre de 2005(consultado el 23 de junio de 2009 ) .
- (en) D. Bergman , " Hydrodynamics and Third Thin Sound in He II Movies " , Physical Review , vol. 188, n o 1,Octubre de 1949, p. 370–384 ( DOI 10.1103 / PhysRev.188.370 ) Resumen . Disponible para suscriptores de PROLA o para la venta.
- (en) " Tabla periódica: helio " (consultado el 23 de junio de 2009 ) .
- (in) Naima Tariq Nada Taisan, Vijay Singh y Jonathan Weinstein, " Detección espectroscópica de la molécula LiHe " , Physical Review Letters , vol. 110, n o 15,8 de abril de 2013, p. 153201 ( PMID 25167262 , DOI 10.1103 / PhysRevLett.110.153201 , leído en línea , consultado el 10 de diciembre de 2017 ).
- SB " El helio se une al sodio a alta presión " Para ciencia , n o 474,abril de 2017, p. 10.
- (en) Xiao Dong, Artem R. Oganov et al. , " Un compuesto estable de helio y sodio a alta presión " , Nature Chemistry ,6 de febrero de 2017( leer en línea )
- " La química del helio, desconocida en la Tierra, podría existir en planetas gigantes " , en futura-sciences.com ,9 de febrero de 2017(consultado el 9 de febrero de 2017 )
- (en) Jurong Zhang Jian Lv, Hefei Li, Feng Xiaolei Cheng Lu et al. , “ El compuesto raro que contiene helio FeO 2 se estabilizó en las condiciones de la tierra profunda ” , Physical Review Letters , vol. 121, n o 25,21 de diciembre de 2018, p. 1-6, punto n o 255703 ( DOI 10.1103 / PhysRevLett.121.255703 , leer en línea [PDF] ).
- (en) R. Mark Wilson, " Un compuesto que contiene helio en las profundidades de la Tierra se encuentra computacionalmente " , Physics Today ,10 de enero de 2019( DOI 10.1063 / PT.6.1.20190110a ).
- (in) " Focus: Un hogar para el helio dentro de la Tierra " , Physics (in) , vol. 11,21 de diciembre de 2018, Artículo N o 133 ( leer on-line ).
- (en) J. Ackerman y G. Maitland , " Cálculo de la velocidad relativa del sonido en una mezcla de gases " , Undersea Biomed. Res. , vol. 2, n o 4,Diciembre de 1975, p. 305–310 ( leer en línea ).
- (en) Joe Wolfe, " Física en el habla " , phys.unsw.edu.au. (consultado el 23 de junio de 2009 ) .
- ¿Por qué el helio cambia la voz? en futura-sciences.com .
- (en) Martin Grassberger y Astrid Krauskopf , “ asfixia suicida con helio: Informe de tres casos. Suizid mit helium gas: Bericht über drei Fälle. » , Wiener Klinische Wochenschrift , vol. 119, núms . 9-10,2007, p. 323–325 ( DOI 10.1007 / s00508-007-0785-4 )Resumen en alemán. Primera página disponible. Artículo ofrecido a la venta.
- (en) Daniel Engber, " Manténgase fuera de ese globo! " , Slate.com,2006(consultado el 23 de junio de 2009 ) .
- (en) JC Eostain , C. Lemaire , MC-Gardette Chauffour , J. Doucet y R. Naquet , " Estimación de la susceptibilidad humana al síndrome nervioso de alta presión " , Journal of Applied Physiology , vol. 54, n o 4,Abril de 1983, p. 1063-1070 ( leer en línea )Disponible en suscripción personal o institucional.
- (in) WL Hunger Jr. y PB Bennett , " Las causas, los mecanismos y la prevención del síndrome nervioso de alta presión " , Undersea Biomedical Research , vol. 1, n o 1,1974, p. 1-28 ( ISSN 0093-5387 , OCLC 2068005 , PMID 4619860 , leer en línea ).
- (en) Glenn D. Considine (ed.) Enciclopedia de Química de Van Nostrand , Wylie-Interscience, ( ISBN 0-471-61525-0 ) , cap. "Helio" , pág. 764–765 .
- (in) IE Beckwith y CG Miller III , " Aerotermodinámica y transición en el túnel de viento de alta velocidad en Langley de la NASA " , Revisión anual de mecánica de fluidos , vol. 22,1990, p. 419–439 ( DOI 10.1146 / annurev.fl.22.010190.002223 ).
- (en) CI Morris, Combustión inducida por choque en flujos de cuña de alta velocidad , Tesis de la Universidad de Stanford , 2001 [ leer en línea (consultado el 23 de junio de 2009)] .
- https://www.lemondeinformatique.fr/actualites/lire-un-disque-dur-helium-16-to-pour%C2%A0datacenter%C2%A0chez-toshiba-75335.html
- (en) James R. Belcher y William V. Slaton, Richard Raspet Henry E. Bass, Jay Lightfoot , " Gases de trabajo en motores termoacústicos " , The Journal of the Acoustical Society of America , vol. 105, n o 5,1999, p. 2677–2684 ( DOI 10.1121 / 1.426884 )Disponible por suscripción.
- (en) Arjun Makhijani Kevin Gurney, Reparando el agujero de ozono: ciencia, tecnología y política , MIT Press , 1995 ( ISBN 0-262-13308-3 ) .
- (in) H. Jakobsson , " Simulación de la dinámica del gran telescopio solar terrestre " , Transacciones astronómicas y astrofísicas , vol. 13, n o 1,1997, p. 35–46 ( DOI 10.1080 / 10556799708208113 ) Resumen . Artículo de suscripción.
- (en) O. Engvold y RB Dunn RN Smartt, WC Livingston , " Pruebas de vacío VS helio en un telescopio solar " , Óptica aplicada , vol. 22,1983, p. 10–12 ( DOI 10.1364 / AO.22.000010 , leer en línea ) Resumen . Artículo ofrecido a la venta.
- (in) " CERN - LHC: Facts and Figures - LHC booklet guide " ( Archivo • Wikiwix • Archive.is • Google • Qué hacer ) [PDF] , CERN (consultado el 23 de junio de 2009 ) .
- (in) " Criogénicos: baja temperatura, alto rendimiento | CERN ” , en home.cern (consultado el 7 de febrero de 2019 ) .
- (en) B. Fowler y KN Ackles, G. Porlier , "Los efectos de la narcosis por gas inerte es un comportamiento: una revisión crítica " , Undersea Biomedical Research Journal ,1985( PMID 4082343 , leer en línea ).
- (en) JR Thomas , " Reversión de la narcosis por nitrógeno en ratas por presión de helio " , Undersea Biomed. Res. , vol. 3, n o 3,1976, p. 249-259 ( PMID 969027 , leer en línea ).
- (en) JC Eostain y MC-Gardette Chauffour, C. Lemaire, R. Naquet , " Efectos de un H 2 -He-O 2mezcla en el HPNS hasta 450 msw ” , Undersea Biomed. Res. , vol. 15, n o 4,1988, p. 257–270 ( ISSN 0093-5387 , OCLC 2068005 , PMID 3212843 , leer en línea ).
- (en) Scott J. Butcher y Richard L. Jones, Jonathan R. Mayne, Timothy C. Hartley, Stewart R. Petersen , "La mecánica ventilatoria de ejercicio deteriorada con el aparato de respiración autónomo se mejora con heliox ' , European Journal of Fisiología aplicada , Países Bajos, Springer, vol. 101, n o 6,diciembre 2007, p. 659–669 ( DOI 10.1007 / s00421-007-0541-5 )Primera página gratuita, artículo restringido a suscriptores de Springer.
- (en) Albert Stwertka, Guía de los Elementos: Revised Edition , Oxford University Press , Nueva York, 1998, ( ISBN 0-19-512708-0 ) , p. 24 .
- (en) BM Oliver y James G. Bradley, Harry Farrar IV , " Concentración de helio en la atmósfera inferior de la Tierra " , Geochimica y Cosmochimica Acta , vol. 48, n o 9,1984, p. 1759–1767 ( DOI 10.1016 / 0016-7037 (84) 90030-9 ) Resumen gratuito, artículo disponible en suscripción a ScienceDirect.
- (in) " The Atmosphere: Introduction in JetStream - Online School for Weather " , Servicio Meteorológico Nacional , 29 de agosto de 2007 (consultado el 23 de junio de 2009 ) .
- (en) Ø. Lie-Svendsen y MH Rees , " Escape de helio de la atmósfera terrestre: El mecanismo de salida de iones " , Journal of Geophysical Research , vol. 101, n o A21996, p. 2435–2444 ( DOI 10.1029 / 95JA02208 ) Resumen , artículo por suscripción a AGU.
- (en) Nick Strobel, " Notas de astronomía de Nick Strobel cap. Atmósferas ' ,2007(consultado el 23 de junio de 2009 ) .
- (en) Melvin A. Cook , " ¿Dónde está el helio radiogénico de la Tierra? » , Naturaleza , vol. 179,1957, p. 213 ( DOI 10.1038 / 179213a0 ) Resumen , artículo ofrecido a la venta.
- (en) LT Aldrich y Alfred O. Nier , " The Occurrence of Heb 3en fuentes naturales de helio ” , Phys. Rvdo. , vol. 74,1948, p. 1590-1594 ( DOI 10.1103 / PhysRev.74.1590 ) Resumen , artículo sobre suscripción PROLA.
- (en) P. Morrison y J. Pine , " Origen radiogénico de los isótopos de helio en la roca " , Anales de la Academia de Ciencias de Nueva York , vol. 62, n o 3,1955, p. 71–92 ( DOI 10.1111 / j.1749-6632.1955.tb35366.x )Sin resumen , agradecimientos, artículo sobre suscripción a Wiley InterScience.
- (in) RE Zartman , " Helio Argón y Carbono en Gases Naturales " , Revista de Investigación Geofísica , vol. 66, n o 1,1961, p. 277–306 ( DOI 10.1029 / JZ066i001p00277 , leer en línea )Con suscripción a AGU o en oferta.
- (in) Ronald F. Broadhead , " Helio en Nuevo México - demanda de distribución geológica y posibilidades de exploración de recursos " , New Mexico Geology , vol. 27, n o 4,2005, p. 93–10 ( leer en línea [PDF] ).
- (en) Hand, E (2016) Campos masivos de helio encontrados en el área de la grieta de Tanzania ; Science 08 de julio de 2016: vol. 353, edición 6295 , pág. 109-110 DOI : 10.1126 / science.353.6295.109 .
- (en) Mark Winter, " Helio: lo esencial " , Universidad de Sheffield ,2008(consultado el 23 de junio de 2009 ) .
- (en) La enciclopedia de los elementos químicos , op. cit. , p. 258 .
- (en) EM Smith y TW Goodwin, J. Schillinger , “ Desafíos al mundial suply de helio en la próxima década ” , Avances en Ingeniería criogénica , vol. 49A, n o 710, 2003, p. 119-138 ( DOI 10.1063 / 1.1774674 , leer en línea [PDF] ).
- (en) " Resúmenes de productos minerales: helio " [PDF] , Servicio geológico de EE . UU. ,2004(consultado el 23 de junio de 2009 ) .
- (en) VP Belyakov , SG Durgar'yan, BA Mirzoyan et al. , “ Tecnología de membranas - Una nueva tendencia en la separación de gases industriales ” , Ingeniería química y del petróleo , vol. 17, n o 1,1981, p. 19-21 ( DOI 10.1007 / BF01245721 )Primera página gratuita, la continuación de la suscripción a SpringerLink o de pago.
- (in) PI Dee y ETS Walton , " Una investigación fotográfica de la transmutación de litio y boro por protones e iones de litio por el isótopo pesado de hidrógeno " , Actas de la Royal Society de Londres , vol. 141, n o 8451933, p. 733-742 ( DOI 10.1098 / rspa.1933.0151 )Acceso de pago o por suscripción para no miembros de la Royal Society .
- (in) RK Kochhar , " Astrónomos franceses en la India durante los siglos XVII-XIX " , Revista de la Asociación Astronómica Británica , vol. 101, n o 21991, p. 95–100 ( leer en línea ).
- (en) La enciclopedia de los elementos químicos , op. cit. , p. 256 .
- (en) William Thomson, Frankland y Lockyer encuentran las prominencias amarillas para dar una línea muy brillante Decidido no muy lejos de la meta D Hasta ahora no se identificaba con ninguna llama terrestre. Parece indicar una nueva sustancia, a la que proponen llamar helio. , Rep. Brit. Assoc. xcix , 1872.
- definición de Cleveítis .
- (en) La Enciclopedia de los elementos químicos , op. cit. , p. 257 .
- (en) William Ramsay , " era gas que muestra el espectro del helio, la causa supuesta de D3, una de las líneas en el espectro coronal. Nota preliminar ” , Actas de la Royal Society of London , vol. 58,1895, p. 65–67 ( DOI 10.1098 / rspl.1895.0006 )Pagado o por suscripción para no miembros de la Royal Society .
- (en) William Ramsay , " Helio, un constituyente gaseoso de ciertos minerales. Parte I ” , Actas de la Royal Society of London , vol. 58,1895, p. 80–89 ( DOI 10.1098 / rspl.1895.0010 )Pagado o por suscripción para no miembros de la Royal Society.
- (en) William Ramsay , " Helio, un constituyente gaseoso de ciertos minerales. Parte II ” , Actas de la Royal Society of London , vol. 59,1895, p. 325–330 ( DOI 10.1098 / rspl.1895.0097 )Pagado o por suscripción para no miembros de la Royal Society .
- (De) NA Langlet , " Das Atomgewicht des Heliums " , Zeitschrift für anorganische Chemie , vol. 10, n o 1,1895, p. 289–292 ( DOI 10.1002 / zaac.18950100130 )En venta o por suscripción a Wiley InterScience.
- (en) ER Weaver, Química industrial y de ingeniería , 1919, cap. “ Bibliografía de la literatura sobre helio ” .
- (en) Pat Munday, American National Biography , John A. Garraty y Mark C. Carnes (ed.), Oxford University Press , 1999 " Entrada biográfica para WF Hillebrand (1853-1925), geoquímico y administrador de la Oficina de Estándares de los Estados Unidos » , Vol. 10-11, pág. 227–228 .
- (in) Dirk van Delft , " Una pequeña taza de helio, una gran ciencia " , Physics today ,2008, p. 36–42 ( leer en línea [PDF] ).
- (en) " Frío más frío " , Time Inc. ,1929(consultado el 23 de junio de 2009 ) .
- (en) P. Kapitza , " Viscosidad del helio líquido λ debajo del punto " , Nature , vol. 141,1938, p. 74 ( DOI 10.1038 / 141074a0 ).
- (en) DD Osheroff y RC Richardson, DM Lee , " Evidencia de una nueva fase de Solid Heb 3 " , Phys. Rvdo. Letón. , vol. 28, n o 14,1972, p. 885–888 ( DOI 10.1103 / PhysRevLett.28.885 ) Resumen . Artículo propiedad de PROLA.
- (en) DF McFarland , " Composición de gas de un pozo en Dexter, Kan " , Transacciones de la Academia de Ciencias de Kansas , vol. 19,1903, p. 60–62 ( DOI 10.2307 / 3624173 , leer en línea )Primera página. Artículo completo bajo los términos de JSTOR.
- (en) " El descubrimiento del helio en el gas natural " , American Chemical Society ,2004(consultado el 23 de junio de 2009 ) .
- (en) HP Cady y DF McFarland , " Helio en gas natural " , Science , vol. 24,1906, p. 344 ( DOI 10.1126 / science.24.611.344 )Sin resumen . Artículo a la venta, o miembros de AAAS.
- (En) HP Cady y DF McFarland , " Helio en Kansas Natural Gas " , Transacciones de la Academia de Ciencias de Kansas , vol. 20,1906, p. 80–81 ( DOI 10.2307 / 3624645 , leer en línea [ archivo de27 de mayo de 2012] )<Sin resumen . Artículo bajo condiciones JSTOR.
- (en) Eugene M. Emme, (ed.) Aeronautics and Astronautics: An American Chronology of Science and Technology in the Exploration of Space, 1915-1960 , NASA , Washington, DC, 1961 [ leer en línea (consultado el 23 de junio de 2009 )] , cap. " Cronología de la aeronáutica y la astronáutica, 1920-1924 " , pág. 11-19 .
- (in) N. Hilleret, S. Turner (ed.) CERN Accelerator School, tecnología de vacío: actas: Scanticon Conference Centre, Snekersten, Dinamarca, 28 de mayo - 3 de junio de 1999 , CERN , Ginebra, Suiza, 1999 [ leer la línea ( página consultada el 23 de junio de 2009)] , cap. " Detección de fugas " , pág. 203–212 . “El inicio del método de detección de fugas de helio debe remontarse al Proyecto Manhattan y los requisitos de sellado sin precedentes de las plantas de separación de uranio. La sensibilidad requerida para la verificación de la estanqueidad llevó a la elección del espectrómetro de masas diseñado por el Dr. AOC Nier y calibrado en la masa del helio. "
- (en) John G. Williamson , " Energía para Kansas " , Transacciones de la Academia de Ciencias de Kansas , Academia de Ciencias de Kansas , vol. 71, n o 4,invierno 1968, p. 432–438 ( leer en línea )Primera página. Artículo completo bajo los términos de JSTOR.
- (En) - , " Venta de helio de conservación " , Registro Federal , vol. 70, n o 193,6 de octubre de 2005, p. 58464 ( leer en línea [PDF] ).
- (en) " Resumen ejecutivo: El impacto de vender la Reserva Federal de helio " , nap.edu ( ISBN 978-0-309-07038-6 , consultado el 23 de junio de 2009 ) .
- (in) PV Mullins, RM Goodling Helium , Bureau of Mining / Minerals Yearbook 1949, 1951 [ leer en línea (consultado el 21 de junio de 2009)] , p. 599–602 .
- (en) estudio de venta de helio de la Reserva de la Nación ,agosto 2010.
- (in) GR Matos, JB Peterson, " Helium End User Statistic " , US Geological Survey (consultado el 23 de junio de 2009 ) .
- (en) Karen H. Kaplan , " La escasez de helio obstaculiza la investigación y la industria " , Physics Today , Instituto Americano de Física , vol. 60, n o 6,junio de 2007, p. 31–32 ( DOI 10.1063 / 1.2754594 , leer en línea ).
- (en) Sourish Basu y Philip Yam (ed.) , " Actualizaciones: Into Thin Air " , Scientific American , Scientific American, Inc. , vol. 297, n o 4,octubre de 2007, p. 18 ( leer en línea ).
- Ludovic Pillevesse, " La prefectura otorgará o no, en septiembre, un permiso exclusivo para la investigación de helio en Nièvre ", Le journal du Centre ,31 de agosto de 2020( leer en línea )
Ver también
Bibliografía
a. (en) Z. Cai, R. Clarke, N. Ward, WJ Nuttall, BA Glowacki, " Modelado de mercados de helio " [PDF] , Universidad de Cambridge ,2007(consultado el 22 de junio de 2009 ) .
Artículos relacionados
- Superfluidez
- Criogenia
- Química de gas noble
- Calefacción o efecto Leidenfrost
- Conservar la carne
- Detección de fugas
-
Helio metaestable

enlaces externos
- “ El descubrimiento de helio líquido en 1908 por Kamerlingh ” , BibNum (consultado el 21 de junio de 2009 ) , texto comentado.
- (en) " Technical data for Helium " (consultado el 23 de abril de 2016 ) , con los datos conocidos de cada isótopo en subpáginas
- Registros de autoridad :
- Avisos en diccionarios generales o enciclopedias :
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | dieciséis | 17 | 18 | ||||||||||||||||
| 1 | H | Oye | |||||||||||||||||||||||||||||||
| 2 | Li | Ser | B | VS | NO | O | F | Nació | |||||||||||||||||||||||||
| 3 | N / A | Mg | Alabama | sí | PAG | S | Cl | Arkansas | |||||||||||||||||||||||||
| 4 | K | Eso | Carolina del Sur | Ti | V | Cr | Minnesota | Fe | Co | O | Cu | Zn | Georgia | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nótese bien | Mes | Tc | Ru | Rh | Pd | Ag | CD | En | Sn | Sb | Tú | I | Xe | |||||||||||||||
| 6 | Cs | Licenciado en Letras | La | Esto | Pr | Dakota del Norte | Pm | Sm | Tenido | Di-s | Tuberculosis | Dy | Ho | Er | Tm | Yb | Leer | Hf | Tu | W | Re | Hueso | Ir | Pt | A | Hg | Tl | Pb | Bi | Correos | A | Rn | |
| 7 | P. | Real academia de bellas artes | C.A | Th | Pensilvania | U | Notario público | Podría | Soy | Cm | Bk | Cf | Es | Fm | Maryland | No | Lr | Rf | Db | Sg | Bh | Hs | Monte | Ds | Rg | Cn | Nueva Hampshire | Florida | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||
|
Metales alcalinos |
Tierra alcalina |
Lantánidos |
Metales de transición |
Metales pobres |
metal- loids |
No metales |
genes de halo |
Gases nobles |
Elementos sin clasificar |
| Actínidos | |||||||||
| Superactinidas | |||||||||