Dihidrógeno
| Dihidrógeno | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificación | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nombre IUPAC | hidrógeno | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sinónimos |
hidrógeno |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100,014,187 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CE | 215-605-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o E | E949 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sonrisas |
[HH] , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / H2 / h1H |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | gas comprimido inodoro, incoloro | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades químicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fórmula |
H 2 [isómeros] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa molar | 2.01588 ± 0.00014 g / mol H 100%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fusión | −259,1 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° hirviendo | −252,76 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilidad |
21,4 ml en 1 l de agua (es decir, 1,92 mg / l ) ( 0 ° C ) 8,5 ml en 1 l de agua ( es decir, 0,76 mg / l ) ( 80 ° C ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parámetro de solubilidad δ | 6,9 MPa 1/2 ( 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad |
0,089 88 g / l (gas, CNTP ), 0,070 8 kg / l (líquido, −253 ° C ), ecuación:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura de autoignición | 500 hasta 571 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| punto de inflamabilidad | gas inflamable | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Límites explosivos en el aire | 4 - 76 % vol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor saturante |
ecuación:
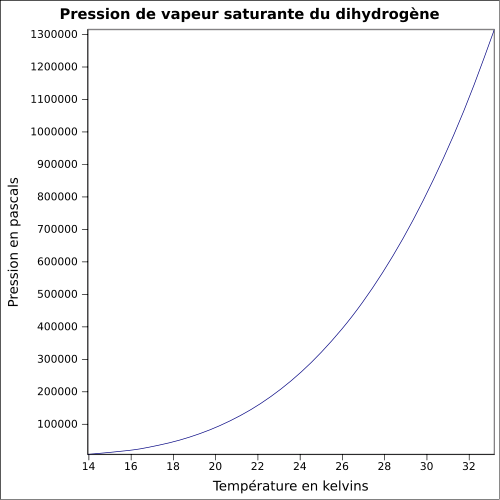
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto crítico | 13,0 bares, −239,95 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Triple punto |
-259,3467 ° C ; 7,205 kPa abs |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 42,5 × 10 −5 cal cm −1 s −1 K −1 a 16,85 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 1310 m s −1 ( 27 ° C , 1 atm ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termoquímica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 gas, 1 bar | 130,68 J K −1 mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ fus H ° | 0,058 68 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ vapor H ° | 0,90 kJ mol −1 ( 1 atm , −252,76 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p | 14 266 J kg −1 K −1 a 293 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCS | 285,8 kJ / mol ( 25 ° C , gas) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCI | 242,7 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Precauciones | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Peligro H220 H220 : gas extremadamente inflamable |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  A, B1, A : Temperatura crítica del gas comprimido = −239,9 ° C B1 : Límite inferior de inflamabilidad del gas inflamable = 4,0% Divulgación al 1,0% según los criterios de clasificación |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| gas:
4
0
0
líquido refrigerado: 4 3 0 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transporte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
23 : gas inflamable Número ONU : 1049 : HIDRÓGENO COMPRIMIDO Clase: 2.1 Código de clasificación: 1F : Gas comprimido, inflamable; Etiqueta: 2.1 : Gases inflamables (corresponde a los grupos designados con una F mayúscula); 
223 : gas licuado refrigerado, inflamable Número ONU : 1966 : LÍQUIDO REFRIGERADO DE HIDRÓGENO Clase: 2.1 Código de clasificación: 3F : gas licuado refrigerado, inflamable; Etiqueta: 2.1 : Gases inflamables (corresponde a los grupos designados con una F mayúscula);  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inhalación | asfixia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unidades de SI y STP a menos que se indique lo contrario. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El dihidrógeno es la forma molecular del elemento hidrógeno que existe como gas en condiciones estándar de temperatura y presión . Las moléculas tienen dos átomos de hidrógeno; su fórmula química es H 2 . También se le llama "hidrógeno molecular" o, en estado gaseoso, "gas hidrógeno". En el lenguaje cotidiano, cuando no hay ambigüedad con el elemento químico del mismo nombre, con mucha frecuencia se lo denomina simplemente "hidrógeno", y a veces hablamos simplemente de "molécula de hidrógeno" para la molécula de hidrógeno.
Se usó en aeronaves tipo zepelín , aprovechando las propiedades del empuje de Arquímedes , antes de ser reemplazado por helio , que es menos peligroso porque no es combustible. Hoy, el consumo global de hidrógeno es de alrededor de 50 millones de toneladas por año. La mayor parte de la producción de hidrógeno se consume in situ, principalmente en la industria química y petroquímica: síntesis de amoniaco (50%), refinado y desulfuración de hidrocarburos (37%), síntesis de metanol (12%). Está compuesto en un 96% por hidrocarburos (metano, petróleo, carbón) y un 4% por electrólisis de agua . Esta producción se acompaña en 2020 de la producción de 830 millones de toneladas de CO 2por año, o alrededor del 2% de las emisiones globales .
Es un gas ligero que la gravedad de la Tierra no puede contener. Arde en el aire produciendo agua , de ahí su nombre compuesto por el prefijo "hidro", del griego ὕδωρ (hudôr) que significa "agua", y por el sufijo "gen", del griego γεννᾰν (gennen), "Engendrar". . Se ha utilizado en particular para conservar la carne . Dihidrógeno tiene una temperatura de vaporización de 20,27 K y una temperatura de fusión de 14,02 K . Bajo presiones muy altas , como las que existen en el centro de los gigantes gaseosos , estas moléculas se disocian y el hidrógeno se convierte en un metal líquido. En el espacio, las nubes de H 2 son la base de la formación de estrellas proceso .
Histórico
El primer científico conocido que describió la producción de dihidrógeno fue el suizo Paracelso (1493-1541). Hizo este descubrimiento vertiendo vitriolo sobre polvo de hierro , pero no entendió la naturaleza exacta del gas emitido durante el experimento .
El químico inglés Henry Cavendish (1731-1810), repitiendo los experimentos de Paracelso con varios metales diferentes, descubre que el gas así producido es diferente del aire, es inflamable y tiene una densidad baja. Llamó a este gas "aire inflamable" (en inglés: aire inflamable ) y encuentra que su combustión es el producto del agua . El dioxígeno se le llamó "aire vital".
El químico francés Antoine Lavoisier, habiendo confirmado los experimentos de Cavendish, propone la palabra "hidrógeno" para reemplazar la expresión "aire inflamable". Esta palabra se forma con el prefijo hidro (del griego ὕδωρ (hudôr), “agua”) y el sufijo gen (del griego γεννᾰν (gennen), “generar”). La palabra hidrógeno por tanto significa que genera agua .
Posteriormente, en el ámbito científico, se utilizará la palabra "hidrógeno" para nombrar el elemento químico H y la palabra "hidrógeno" para la molécula H 2 .
Propiedades químicas
Prueba de reconocimiento
Para probar la presencia de dihidrógeno, se acerca un tronco en llamas a un tubo de ensayo que contiene dihidrógeno. La reacción química de la combustión del hidrógeno con el oxígeno del aire, iniciada por la fuente de calor, produce un ruido característico llamado "ladrido" o "ladrido".
Combustión
La combustión de hidrógeno en dioxígeno , que produce agua , es 2 H 2 (g) + O 2(g) → 2 H 2 O(la). Es particularmente violento (ver prueba de reconocimiento) y muy exotérmico : su poder calorífico es de 141,86 MJ / kg [o 141,79 MJ / kg ] (a 25 ° C [o 15 ° C ] por debajo de 1 atm ), o una entalpía estándar de combustión , a 25 ° C , de −285,84 kJ / mol , a 100 ° C , de −283,45 kJ / mo l (H 2 gas, O 2 gas, pero H 2 O líquido , como poder calorífico superior o PCS), pero de 120,1 MJ / kg [o 119,93 MJ / kg ], es decir una entalpía de combustión, a 100 ° C , de -242,8 kJ / mol (H 2 gas, gaseoso o 2 , H 2 o vapor , como valor calorífico inferior o NCV , contando 40.660 kJ / mol para la vaporización de agua a 100 ° C ), contra, por ejemplo, solo 49.51 MJ / kg para el butano . Esta propiedad lo convierte en un combustible de elección para las naves espaciales, pero hace que su almacenamiento sea peligroso.
La misma oxidación más lenta se utiliza para producir electricidad en la pila de combustible .
Formas orto y para
El hidrógeno gaseoso es una mezcla de dos tipos de moléculas isoméricas que se diferencian entre sí en el giro de sus núcleos atómicos . Estas dos formas se denominan orto- y para-hidrógeno , y la forma orto (espines paralelos, estado de triplete) corresponde a un estado excitado, que no existe en su estado puro. En condiciones normales de temperatura y presión , por excitación térmica, el hidrógeno está compuesto por un 75% de la forma orto y un 25% de la forma para. A 77 K la mezcla en equilibrio (alcanzado espontáneamente en varios días, pero en pocas horas con catalizadores) está al 50%. Pero a muy baja temperatura, la forma orto se transforma completamente en el estado para (espines antiparalelos, estado singlete) con el tiempo. Las dos formas tienen niveles de energía ligeramente diferentes y, por lo tanto, propiedades fisicoquímicas ligeramente diferentes . Por ejemplo, el punto de fusión y el punto de ebullición del parahidrógeno son aproximadamente 0,1 K más bajos que el del orto- .
Fuentes de hidrogeno
El dihidrógeno es un gas muy ligero. Dado que la gravedad de la Tierra no puede detenerlo, naturalmente escapa de la atmósfera terrestre. Por lo tanto, solo está presente en cantidades mínimas (0,5 ppmv ) en el aire . Esta escasez atmosférica significa que todo el dihidrógeno utilizado se produce industrialmente mediante varios procesos, a partir de moléculas en las que los átomos de hidrógeno están unidos químicamente.
Sin embargo, hay algunos contextos geológicos donde el dihidrógeno brota naturalmente de la Tierra . El hidrógeno que emana de estas zonas se designa con el término hidrógeno natural .
Hidrógeno artificial
La producción de hidrógeno implica muchos procesos diferentes , el átomo de hidrógeno forma una serie de moléculas ( agua , hidrocarburos , azúcares , etc. ).
Método histórico de producciónHistóricamente, en XIX XX siglo, el dihidrógeno se obtuvo mediante la emisión de vapor de agua (H 2 O) en un barril lleno de limaduras de hierro y virutas. El vapor de agua oxidó el metal, creando óxido de hierro en un lado y liberando hidrógeno en el otro. Este último luego salió del barril, donde se filtró a otro barril lleno de agua, luego se almacenó directamente en un aerostato . Este dispositivo permitió al ejército inflar un globo de observación en cualquier lugar y en unas pocas horas .
Métodos actualesEn 2015, el hidrógeno se produjo industrialmente mediante varios procesos:
- para el 49% mediante reformado con vapor de hidrocarburos (en particular a partir de metano , ver Reformado de metano );
- al 29% por oxidación parcial del petróleo
- al 18% por gasificación de carbón
- al 4% por electrólisis de agua .
También se están estudiando otros procesos, desde el craqueo u oxidación parcial, que tiene la ventaja de ser exotérmico .
Reformado de vapor de hidrocarburosEl reformado con vapor de hidrocarburos es el método que en el comienzo de la XXI XX siglo, es el más utilizado a nivel industrial. Su principio se basa en la reacción de hidrocarburos (metano, etc.) en presencia de vapor de agua y calor. La reacción global está escrita:
.La eficiencia energética ronda el 40 al 45% en algunas instalaciones . En la práctica industrial, es necesario acelerar la reacción mediante catalizadores o quemadores. Tiene la desventaja de producir dióxido de carbono , un gas de efecto invernadero .
Actualmente se están estudiando tecnologías catalíticas o más innovadoras como los reformadores de plasma.
Electrólisis de aguaLa electrólisis del agua es una tecnología que consiste en hacer pasar una corriente eléctrica (directa) en agua (a la que previamente se le ha añadido un electrolito como la sosa cáustica ) con el fin de obtener la disociación de las moléculas de agua en hidrógeno y oxígeno .
Reacción en el ánodo :
2 H 2 O(l) → O 2(g) + 4 H + (aq) + 4 e -Reacción en el cátodo :
4 H 2 O(l) + 4 e - → 2 H 2 (g) + 4 OH - (aq)Reacción en agua:
4 H + (ac) + 4 OH - (ac) → 4 H 2 O (la)Reacción general:
2 H 2 O(l) → 2 H 2 (g) + O 2 (gramo)donde (l), (g) y (aq) significan "en fase líquida", "en fase gaseosa" y "en solución acuosa" respectivamente.
Esta tecnología requiere grandes cantidades de electricidad. Según Ademe en 2020, la eficiencia de la cadena de hidrógeno en Power-to-H2-to-Power es del 25%, mientras que la de las baterías eléctricas es del 70%. Por tanto, se utiliza relativamente poco.
Oxidación parcial de hidrocarburosEsta reacción es una combustión "rica" en el sentido de que el objetivo es producir un gas rico en H 2 y CO (gas de síntesis); en lugar de los productos "clásicos" de CO 2 y H 2 O.
La reacción está escrita:
.La mayoría de las veces, el aire se utiliza como oxidante. Entonces tenemos:
.La reacción es exotérmica: por ejemplo, la entalpía de la reacción con metano es -35,7 kJ mol -1 .
Al igual que la reacción de reformado con vapor, es necesario catalizar la reacción.
El interés de la reacción de oxidación parcial radica en su naturaleza exotérmica (a diferencia de la reacción de reformado con vapor) que ayuda a la catálisis (aumento de temperatura).
Los principales mentiras de devolución en el hecho de que los porcentajes de H 2 son más bajos que los obtenidos por el reformado con vapor, debido a la presencia mayoritaria de nitrógeno en el aire. Además, existe el riesgo de obtener NO x .
Acción de un ácido sobre un metalEl dihidrógeno se produce por la acción de un ácido sobre un metal. Ejemplo :
.El dihidrógeno también se puede producir haciendo reaccionar hidróxido de sodio con aluminio, de acuerdo con la fórmula:
Producción por fotosíntesis (cianobacterias)Algunas cianobacterias pueden descomponer químicamente el agua en oxígeno e hidrógeno mediante reacciones fotosintéticas. Esto permitiría producir hidrógeno utilizando energía solar . Se están realizando investigaciones en esta área, particularmente en términos de ingeniería genética .
Hidrógeno natural
El hidrógeno producido en la Tierra de forma natural, a diferencia del hidrógeno producido artificialmente mediante la reforma de metano o hidrocarburos , se dice que es hidrógeno natural o hidrógeno nativo .
La distribución, capacidad de producción y mecanismos físico-químicas de sus fuentes o depósitos siguen siendo objeto de estudios exploratorios en el comienzo del XXI ° siglo. Así, en abril de 2019 se puso en marcha el proyecto de investigación sen4H2, cofinanciado por la Agencia Espacial Europea , que tiene como objetivo detectar emisiones de hidrógeno natural mediante imágenes de satélite.
Fuentes de hidrógeno naturalLa producción de hidrógeno natural en la columna vertebral se conoce desde la década de 1970 y se ha estudiado más recientemente. Estos son serpentinización reacciones ( redox de olivino ) entre el agua y el rocas ígneas ras con el manto de la Tierra , facilitado por el calor de estas reacciones exotérmicas : el oxígeno del H 2 O moléculas.capturado por el hierro en la roca, los átomos de hidrógeno son libres de asociarse en H 2. El hidrógeno así producido escapa a través de respiraderos hidrotermales y, opcionalmente, puede reaccionar a su vez para formar metano y luego hidrocarburos más pesados. Demasiado profundo, estos depósitos no se pueden explotar en 2018
Las emisiones de hidrógeno también han sido descubiertas en medio de cratones continentales por el geólogo ruso Nicolay Larin, siguiendo su trabajo sobre la hipótesis de la Tierra hidratada. El IFP Energies nouvelles ha confirmado este descubrimiento en 2013, informando temas de importancia local, en la mayoría de los continentes, Rusia , Estados Unidos , Brasil , Omán o Mali .
El fenómeno aún es poco conocido y el debate sobre el mecanismo exacto que genera estas emisiones aún no se ha zanjado. Podría tratarse de la hidratación del hierro mediante agua infiltrada, estando ésta presente en los cinturones de piedra verde , presente en los cratones. Así, en Kansas , cerca de Junction City , se identificó un depósito en la década de 1980 y fue objeto de renovado interés en la década de 2000; el dihidrógeno se obtendría allí a partir de tales reacciones de oxidación del hierro. En Rusia, el IFP estimó en 2010 el flujo diario de una sola depresión en varias decenas de miles de metros cúbicos , o el consumo equivalente a 500 taxis. Un original geológico o hidrogeológico también prevalece para las liberaciones de hidrógeno estudiadas en Brasil, en algunos círculos de hadas ubicados en la cuenca de São Francisco .
En Yanartaş , Turquía, los “incendios milenarios” del Monte Quimera serían la combustión de un gas compuesto de metano (87%), hidrógeno (7,5 a 11%) y dinitrógeno (2 a 4,9%), teniendo un doble origen: el serpentinización por un lado, un gas termogénico por el otro. Serían la fuente original de la llama olímpica .
El Mali es, en 2015, el único país donde se utiliza el hidrógeno natural, en el pueblo de Bourakébougou , a 60 kilómetros al norte de Bamako . El gas provendría de una "sobremaduración del petróleo" probablemente enterrado cerca y sus reservas se estiman en unos 1.500 millones de metros cúbicos . La presión en los pozos no disminuye, por lo que el relleno se llena constantemente, lo que permite la sustentabilidad de esta operación.
Los gases volcánicos a menudo contienen trazas de hidrógeno. Así, en Hawái, un estudio espectroscópico realizado sobre un fuego de gas volcánico mostró que se trataba de una combustión de dihidrógeno.
Cualquier roca ígnea contendría hidrógeno, hasta unos 5 l / m 3 ; por lo tanto, todos los pozos muestran desgasificación de hidrógeno. Durante el experimento ruso de perforación sg3 , se describió que el lodo extraído del pozo burbujeaba con este gas .
ApuestasA diferencia del hidrógeno artificial, que requiere energía para producirse, lo que lo reduce a ser solo un portador de energía , el hidrógeno natural es una fuente real de energía , cuya combustión no produce solo agua. Además, las coproducciones podrían ser posibles con energía geotérmica o extracción de helio , lo que podría ayudar al sector a ser competitivo. Sin embargo, en 2020 el potencial industrial no está cuantificado con precisión y la legislación minera no tiene en cuenta el hidrógeno en muchos países. La detección de hidrógeno in situ es realmente difícil, aunque se han desarrollado detectores más eficientes.
Usos industriales
El consumo mundial de hidrógeno en la actualidad es de alrededor de 50 millones de toneladas por año. La mayor parte de la producción de hidrógeno se consume in situ, principalmente en la industria química y petroquímica: síntesis de amoníaco (50%), refinado y desulfuración de hidrocarburos (37%), síntesis de metanol (12%).
Los principales usos industriales del hidrógeno son:
- el método Haber-Bosch (producción de amoniaco ), la hidrogenación de grasas y aceites y la producción de metanol ;
- la fabricación de ácido clorhídrico , la soldadura , los combustibles para cohetes y la reducción de minerales metálicos;
- el dihidrógeno líquido se utiliza para la investigación a muy bajas temperaturas, incluido el estudio de la superconductividad ;
- el hidrógeno se utiliza como gas trazador para realizar operaciones de detección de fugas en diversos campos (refinación de petróleo, automóviles, instalaciones de calefacción, red de distribución de agua, tanques de aviones, etc.);
- el hidrógeno es un aditivo alimentario autorizado con el código E949 , en la categoría de trazadores;
- el hidrógeno también se utiliza como fluido caloportador en determinadas máquinas de alta potencia (alternador de planta de energía síncrona, por ejemplo);
- el hidrógeno se usó en aerostatos porque es catorce veces menos denso que el aire, pero ha sido reemplazado por helio por razones de seguridad; todavía se utiliza para algunos globos meteorológicos en estaciones remotas.
- El dihidrógeno se probó como combustible para la aeronáutica durante un vuelo el 15 de abril de 1988 con el Tupolev Tu-155.
Ciertos isótopos del hidrógeno también tienen un uso industrial o tecnológico particular:
- el deuterio ( 2 H) se utiliza en aplicaciones nucleares como moderador ( agua pesada o D 2 O) para ralentizar los neutrones . Los compuestos de deuterio también se utilizan en química y biología para estudiar o utilizar el efecto isotópico ;
- el tritio ( 3 H), otro isótopo, se produce en reactores nucleares y se utiliza para la construcción de bombas atómicas . También se utiliza como marcador isotópico en biociencias y como fuente de radiación en pinturas luminiscentes;
- El deuterio y el tritio también se fusionan en reactores de investigación y se consideran para proyectos controlados de fusión nuclear en la Tierra.
Hasta la fecha, se están considerando tres formas principales de almacenar hidrógeno a bordo de un vehículo:
- almacenamiento en forma de gas comprimido;
- almacenamiento en forma líquida a baja temperatura;
- almacenamiento en forma sólida, luego el hidrógeno se une a otros componentes (por adsorción o en forma de compuesto químico).
Gas comprimido
Es la forma más común de almacenamiento de hidrógeno.
El almacenamiento de gas en forma comprimida (actualmente 350 bares) permite alcanzar una densidad de masa satisfactoria con tanques compuestos. La densidad del volumen de almacenamiento sigue siendo baja: una presión de 700 bares es inevitable para que la tecnología sea competitiva.
La tecnología existe y se usa comúnmente. Su inconveniente radica en la energía requerida para la compresión y en la baja eficiencia en términos de tamaño en comparación con otros métodos. Este volumen es una de las dificultades para el uso de dihidrógeno en forma de gas comprimido en aplicaciones de automoción.
Cuando se comprime, la densidad del hidrógeno a 20 MPa ( 200 bar) es aproximadamente 16,8 kg / m 3 , a 35 MPa ( 350 bar) aproximadamente 23 kg / m 3 y a 70 MPa ( 700 bar)) de aproximadamente 38 kg / m 3 . Esto corresponde a una densidad de densidad de energía de 767 kWh / m 3 (27 ° C, 35 MPa) y aún a una densidad de densidad de energía de 33,3 kWh / kg.
El almacenamiento de líquidos a 20 K ( −253 ° C ) por debajo de 10 bares permite lograr interesantes densidades de volumen y masa, pero requiere tanques con alto aislamiento térmico para minimizar la evaporación.
La tecnología está ahí. Tiene una mejor eficiencia de volumen que el almacenamiento de gas comprimido ( 70 kg / m 3 contra 10 kg / m 3 a 115 bares y 0 ° C ). Sin embargo, esta ventaja se ve moderada por el volumen relativamente grande de los recintos aislantes necesarios.
Por otro lado, se requiere una cantidad significativa de energía para pasar a la fase líquida: la licuefacción consume del 30 al 40% del contenido energético del gas y la pérdida en uso real es significativa (actualmente 1,25 por mil por hora), fuertemente penalizando el almacenamiento más allá de una semana.
Esta técnica se utiliza en particular en el sector espacial donde, a pesar del corto tiempo de implementación, el llenado es continuo hasta el último momento.
Hidruros metálicos
El almacenamiento sobre sustratos en forma adsorbida, en particular sobre hidruros metálicos , tiene una densidad de volumen muy interesante pero una densidad de peso baja. Además, la cinética, la temperatura y la presión cíclica siguen siendo puntos difíciles de controlar.
Los átomos de hidrógeno se almacenan en algunos compuestos metálicos. El hidrógeno se recupera calentando o reduciendo la presión. Esta técnica es poco conocida hoy en día. Tiene el inconveniente de requerir un dihidrógeno extremadamente puro para no destruir la capacidad de absorción de los hidruros. La calefacción para recuperar gas también es una desventaja. Este tipo de almacenamiento, que sigue siendo objeto de investigación, se encuentra en fase de desarrollo industrial y están previstos algunos proyectos demostrativos, por ejemplo con la start-up McPhy que está desarrollando tecnología de hidruro de magnesio (tecnología del CNRS, Instituto NEEL) .
Capacidad de almacenamiento de determinados hidruros.
| Hidruro | Porcentaje en masa de H 2 contenido |
|---|---|
| LaNi 5 H 6.5 | 1.4 |
| ZnMn 2 H 3.6 | 1.8 |
| TiFeH 2 | 1,9 |
| Mg 2 NiH 4 | 3.6 |
| VH 2 | 3.8 |
| MgH 2 | 7,6 |
Un metal muy estudiado es el paladio que, a través de su hidruro PdH 2, tiene la capacidad de absorber una gran cantidad de hidrógeno dentro de su red cristalina. A temperatura ambiente y presión atmosférica, el paladio puede absorber hasta 900 veces su volumen de gas hidrógeno, siendo el proceso reversible.
La adsorción sobre carbón permite almacenar en la superficie de determinadas estructuras de carbón , como el carbón activado o los nanotubos , las moléculas de hidrógeno. Permite almacenar entre un 0,05 y un 2% en masa de dihidrógeno .
Este tipo de almacenamiento se encuentra en etapa de investigación.
Producción y usos
En un informe publicado en junio de 2019, la Agencia Internacional de la Energía destaca la versatilidad del hidrógeno, que puede producirse a partir de todos los combustibles fósiles, renovables y nucleares, puede transportarse en forma gaseosa o líquida y convertirse en electricidad o en metano para una amplia gama de usos.
Podemos distinguir tres categorías de hidrógeno producido, dependiendo de cómo se produzca (ver la sección Métodos actuales ):
- el gris hidrógeno , producido por conversión de combustibles fósiles sin captura ni almacenamiento de carbono ;
- el azul de hidrógeno , producido por conversión de combustibles fósiles con captura y almacenamiento de carbono;
- el hidrógeno verde producido a partir de la electricidad de fuentes renovables o nuclear ( púrpura para algunos, amarillo para otros).
El hidrógeno producido en la corteza terrestre (por diagénesis y radiólisis ), así como el hidrógeno primordial (presente desde la formación de la Tierra ) son otras posibles fuentes, pero que aún no han sido exploradas.
En 2020, el coste del hidrógeno gris se sitúa entre 1 y 2 € / kg frente a 4 a 7 € / kg para el hidrógeno verde producido de forma industrial. Según Julien Chauvet, director de Hydrogen France de Engie Solutions , "el kilo permite recorrer 100 km, lo que lo pone a la par de la gasolina y es similar al diésel para vehículos ligeros" .
Producción industrial
Actualmente, el hidrógeno se produce casi en su totalidad a partir de gas natural , petróleo y carbón .
Para sus propias necesidades, la industria produce hidrógeno ( por ejemplo: en Francia, más de 900.000 t / año de hidrógeno, en particular para la desulfuración de combustibles derivados del petróleo y para la fabricación de amoniaco en fertilizantes nitrogenados ; el hidrógeno es entonces un insumo químico y no una energía transportista ). El proceso industrial más barato para producir este hidrógeno, en 2018, es el reformado de hidrocarburos , la mayoría de las veces mediante reformado con vapor de gas natural (que se compone principalmente de metano ). A una temperatura entre 700 y 1.100 ° C , el vapor de agua reacciona con el metano para dar monóxido de carbono e hidrógeno. Siendo más fácil la purificación del hidrógeno a alta presión, el reformado se realiza a una presión de veinte bares . La mezcla de hidrógeno / monóxido de carbono se denomina comúnmente " gas de síntesis ". Si la reacción se realiza en presencia de un exceso de vapor de agua, el monóxido de carbono se oxida a un nivel de oxidación más alto, lo que conduce a dióxido de carbono , lo que aumenta la producción de hidrógeno .
La empresa Air Liquide tiene un dominio particular de este proceso. En 2015, encargó en Arabia Saudita , en el sitio de Yanbu , una unidad con una capacidad total de producción de hidrógeno de 340.000 m 3 / h en los CNTP .
En 2019, la Agencia Australiana de Energías Renovables (ARENA) aportará 9,41 millones de dólares australianos (8,5 M € ) a un proyecto del grupo Hazer (empresa australiana de energías renovables) destinado a convertir biogás procedente de la metanización de lodos de depuradora en hidrógeno y grafito . Hazer quiere construir una planta de demostración de US $ 15,8 millones en Munster (Australia Occidental).
Sector del hidrógeno y desafíos para el desarrollo sostenible
La producción industrial “tradicional” de hidrógeno a partir de hidrocarburos fósiles tiene una baja huella de carbono y emite una gran cantidad de gases de efecto invernadero , alcanzando los 830 millones de toneladas de CO 2.por año en 2020, es decir, alrededor del 2% de las emisiones globales y casi tanto como el sector de la aviación o el transporte marítimo. En Francia, estas emisiones ascienden a casi diez millones de toneladas de CO 2 equivalente.por año alrededor de 2015-2017, es decir, el 7,5% de las emisiones de gases de efecto invernadero de la industria francesa, según ADEME . La producción de hidrógeno a partir de electricidad renovable, que es más virtuosa, podría ver caer su costo en un 30% para 2030 gracias al auge de las energías renovables y las economías de escala relacionadas.
El sector del hidrógeno produce, almacena, promueve y mejora la investigación del hidrógeno y del hidrógeno. En 2015, se están realizando experimentos con hidrógeno verde (libre de carbono), pero este gas todavía "se produce principalmente a partir del gas natural ( fósil ) y se utiliza como componente químico en procesos industriales" , con un balance de carbono deficiente y una contribución significativa a la efecto invernadero . No obstante, el sector se presenta como interesante para el desarrollo sostenible , Porque:
- si se produce por electrólisis del agua y sin carbono mediante la recuperación de excedentes de electricidad renovable intermitente (principalmente eólica y fotovoltaica), este vector energético puede almacenarse, en particular en ciclos interestacionales, y luego utilizarse en metanización y / o inyectado a la red de gas (6 a 20% en volumen según las condiciones), facilitando así el equilibrio y la flexibilidad de la red eléctrica ;
- La electricidad que se puede almacenar gracias a su conversión en gas (hidrógeno o metano) permitiría almacenar “del orden de un terravatio-hora al año” y hasta varias decenas de teravatios-hora al año de electricidad según ADEME. , cuando la tasa de penetración de las energías renovables en el mix eléctrico alcance el 80% y, como tal, pueda "hacer una importante contribución a la transición a un modelo energético bajo en carbono, especialmente en el sector del almacenamiento de energía" ;
- el hidrógeno se puede utilizar para producir electricidad localmente, pero con una pérdida de eficiencia; el de la electrólisis del agua se aproxima al 70%, pero la eficiencia general de la producción de electricidad a partir de H 2 sería de alrededor de 25% de acuerdo con Ademe en 2020;
- El hidrógeno es compatible con el autoconsumo de una vivienda, isla o barrio, permitiendo su almacenamiento durante varios días, semanas o meses, además de baterías más útiles para el almacenamiento a corto plazo. Ya estaría económicamente justificado En áreas no interconectadas a la red eléctrica continental ( por ejemplo: islas aisladas, comunidades francesas de ultramar donde la producción de electricidad aún depende del combustible a un alto costo, a 225 € / MWh en promedio en 2013 según a ADEME);
- El hidrógeno puede alimentar ciertas flotas de vehículos profesionales, sin requerir una red costosa de varios cientos de estaciones de servicio en todo el país. Según Ademe, "el modelo económico de una estación para una flota es accesible para un consumo diario superior a 80 kg H 2 / día, para la comercialización de hidrógeno a menos de 10 € / kg " . En este caso, tiene las ventajas de un tiempo de recarga rápido y una gran autonomía;
- El hidrógeno se puede utilizar en la industria del acero como sustituto del carbón o del gas natural para la reducción del mineral de hierro. Utilizar este proceso en Francia consumiría 700.000 toneladas de hidrógeno, pero evitaría la emisión De 22 MtCO 2/ año, o casi el 5% de las emisiones del país, indica la Asociación Francesa de Hidrógeno y Pilas de Combustible (Afhypac).
la 8 de julio de 2020, la Comisión Europea presenta un programa para el desarrollo del hidrógeno verde, estableciendo el objetivo de que el hidrógeno cubra del 12 al 14% de las necesidades energéticas para 2050 con el fin de descarbonizar determinados sectores de la industria y el transporte. Se basa en el hidrógeno para contribuir a la transición energética y a la reducción de las emisiones de gases de efecto invernadero. Al mismo tiempo, el comisario europeo de Comercio Interior, Thierry Breton, anuncia la creación de la alianza del hidrógeno.
En FranciaLa ADEME está considerando un mix eléctrico al 40% compuesto por "renovables" en 2035, luego al 60% y 70% en 2050 (contra casi el 18% en 2017, mientras que la mayoría de fuente hidroeléctrica).
El sector busca industrializar sus procesos para reducir sus costos (en particular el de la pila de combustible ). El desarrollo de la “movilidad del hidrógeno” también se ve obstaculizado por un número todavía muy bajo de estaciones de carga (y su capacidad aún baja: de 10 a 80 kg H 2 / d a 350 bar). El hidrógeno puede mejorar la potencia del vehículo, ampliar su alcance y mejorar la velocidad de recarga, en comparación con las baterías.
Ademe considera que el hidrógeno tendrá un papel importante en la transición energética, como vector para la optimización de las redes energéticas, para el almacenamiento de energía en autoconsumo solar o fotovoltaico, y para determinados vehículos profesionales, a condición de que descarbonice su producción de energía mediante electrólisis. utilizando electricidad verde y transformación de biomasa ( reformado con vapor de biogás , pirogasificación de biomasa sólida). El comportamiento medioambiental del sector dependerá sobre todo de “la fuente primaria utilizada para fabricar hidrógeno”. La agencia pide limitar la distancia de transporte de hidrógeno entre el punto de fabricación y la estación de distribución a menos de cien kilómetros. Se deben preferir los vehículos a batería, cuando sea posible (autonomía, disponibilidad, etc.), dado el mejor rendimiento de este tipo de almacenamiento, y el ahorro de energía sigue siendo una prioridad. Una de las vías de desarrollo (que se está probando actualmente en 2018/2019) es la inyección en la red de gas en Francia a través de dos demostradores: GRHYD y Jupiter 1000 , para eliminar las barreras técnicas que aún existen.
En junio 2018, el gobierno francés obliga a Ademe a poner en marcha el "plan nacional de despliegue de hidrógeno" (o "plan de hidrógeno"), con el fin de dar impulso a este sector cuyo "alto potencial" es percibido por los actores públicos. El objetivo del gobierno es "crear un sector industrial francés libre de carbono, abrir nuevas perspectivas para el almacenamiento de energías renovables y desarrollar soluciones cero emisiones para el transporte" . Un año después, el organismo público realizó múltiples convocatorias de proyectos , entre ellos “Ecosistemas de movilidad de hidrógeno”, que permitieron seleccionar proyectos “en todos los territorios” y diversificados, como “entrega de última milla en áreas urbanas., Transporte colectivo de pasajeros por autobús o lanzadera, alquiler de coches, recogida de basuras, flotas comerciales y comunitarias, o incluso el uso de vehículos pesados como vehículos de construcción ” .
El CEA promete una nueva tecnología de electrólisis industrial, denominada rSOC con un único metal precioso: el indio (un metal utilizado en las pantallas LCD ), con temperaturas más bajas (de 700 ° C a 800 ° C ) y una temperatura más baja.consumo de energía. También es reversible, lo que permite producir hidrógeno o restaurar energía eléctrica como una pila de combustible.
A finales de 2019, Air Liquide y Engie unieron fuerzas con Durance-Luberon-Verdon Agglomeration (DLVA) para producir, almacenar y distribuir "hidrógeno verde" (como parte del proyecto "HyGreen Provence" lanzado en 2017, destinado a 1.300 GWh de electricidad solar y varios miles de toneladas: año de hidrógeno producido por electrólisis Se podrían producir varias decenas de miles de toneladas de hidrógeno renovable por año a largo plazo, que se puede almacenar en una cavidad salina local.
La empresa francesa McPhy , que ya ha instalado 17 MW de capacidad de producción de hidrógeno por electrólisis presurizada, incluidos 6 MW en Audi en Alemania, anuncia en enero de 2020 la firma del contrato de ingeniería para un proyecto de producción de hidrógeno verde industrial de 20 MW , el mayor proyecto hasta la fecha en Europa, ubicado en Delfzijl en los Países Bajos para 2022. La planta producirá 3.000 toneladas de hidrógeno por año mediante electrólisis de agua utilizando energía eólica y se utilizará para fabricar bioetanol. El proyecto se beneficia de 15 millones de euros en subvenciones de la Unión Europea y un fondo holandés. Según McPhy, la escala adecuada será de 100 o 200 MW para lograr un precio competitivo en la industria.
La Ley de Clima Energético de noviembre de 2019 otorga al gobierno un año para establecer un mecanismo de apoyo al "hidrógeno producido a partir de energía renovable o por electrólisis del agua utilizando electricidad baja en carbono" . Antes de 2023, el programa energético plurianual tiene como objetivo descarbonizar el 10% del hidrógeno consumido en la industria, lo que requiere la producción de 90.000 toneladas de hidrógeno verde. En enero de 2020, el gobierno lanza una convocatoria de manifestaciones de interés , destinada a poner a prueba el apetito de los industriales por el tema, que recibe más de 160 proyectos. Por ejemplo, en enero, H2V Industry presenta solicitudes de permisos de construcción para dos plantas de producción de hidrógeno en la zona industrial de Port-Jérôme, en Normandía, y en el gran puerto marítimo de Dunkerque a partir de electricidad renovable; si logran beneficiarse de un mecanismo de apoyo, su puesta en servicio podría tener lugar en 2023-2024 y producirían 56.000 toneladas de hidrógeno. También se han posicionado los principales actores industriales franceses (Engie, EDF, Air Liquide, Vinci, etc. ).
El gobierno de Castex anunció en septiembre de 2020 un plan mucho más ambicioso que el presentado por Nicolas Hulot en 2018, dotado con 100 millones de euros: el plan de 2020 prevé dedicar 7.200 millones de euros para 2030 al hidrógeno verde o bajo en carbono, incluidos 2.000 millones de euros en 2021 y 2022 como parte del plan de recuperación. El gobierno planea subsidiar la producción de hidrógeno verde a través de licitaciones, modeladas en energías renovables, y la construcción de plantas de celdas de combustible para vehículos de hidrógeno. Se están considerando asociaciones con Alemania, que dio a conocer un plan de hidrógeno de 9.000 millones de euros en junio, para evitar duplicaciones.
Este plan de hidrógeno incluye un primer componente de 1.500 millones de euros destinado a la fabricación de electrolizadores, con el fin de reducir el coste mejorando y aumentando los volúmenes, para una capacidad de 6,5 GW . El segundo componente de casi mil millones de euros se utilizará en 2023 para desarrollar una oferta de movilidad de hidrógeno pesado reduciendo el coste y mejorando la eficiencia de las pilas de combustible para trenes, camiones, autobuses y aviones, a través de varias convocatorias de proyectos (350 millones de euros para demostradores, 275 millones para experimentos regionales, etc.). Por último, se impulsarán las ayudas a la investigación y la innovación, con una dotación elevada a 650 millones en 2023. Bruno Le Maire espera que este plan cree entre 50.000 y 150.000 puestos de trabajo directos e indirectos. El gobierno está considerando la cooperación con Alemania descrita como "Airbus para electrólisis" como el "Airbus para baterías". Francia se ha fijado el objetivo de producir 600.000 toneladas anuales de hidrógeno verde, a partir de electricidad libre de carbono, de origen renovable o nuclear. Sin embargo, a diferencia de Alemania, París no subvencionará la captura de carbono del hidrógeno "gris". Bruno Le Maire espera ver "el surgimiento de un sector francés de electrólisis": junto con gigantes como Air Liquide, también son numerosas las empresas emergentes, como Lhyfe , con sede en Nantes, que está desarrollando sitios de producción de hidrógeno verde para fabricantes y autoridades locales. o incluso McPhy , un productor de electrolizadores de Drôme en el que EDF es accionista.
En BélgicaUn equipo de KUL está diseñando un prototipo de celda fotoelectroquímica de 1,6 m 2 que produce un promedio de 250 litros de hidrógeno por día a partir del vapor de agua atmosférico. El dispositivo convierte el 15% de la energía solar en hidrógeno y oxígeno. Y esta tecnología no utiliza metales preciosos ni otros materiales costosos. Con veinte paneles, una casa bien aislada sería autosuficiente en electricidad y calefacción durante un año.
Colruyt Group (un importante minorista belga) quiere descarbonizar sus actividades tanto como sea posible. En 2018, uno de sus centros logísticos se equipó con 75 ascensores propulsados por hidrógeno “libre de carbono” y su flota de camiones debe ser reconvertida para el 2030. Con un actor de gas, se está preparando un proyecto de instalación de 12 a 25 MW (ampliable). convertir la electricidad procedente de turbinas eólicas marinas en hidrógeno , a escala industrial.
En JapónA finales de 2017, Japón, importante importador de energía, confirmó que quería convertirse en líder como “ empresa de hidrógeno ” con el objetivo de “paridad de costes” con la gasolina y el GNL para la producción de electricidad. Al igual que con la energía nuclear en el pasado, el hidrógeno se presenta como un medio importante para descarbonizar la energía, pero los proyectos piloto darán sus conclusiones alrededor de 2020. En 2018, Japón está a la cabeza de la movilidad del hidrógeno, con casi 2.500 automóviles con pilas de combustible de hidrógeno en circulación y más de cien estaciones de hidrógeno (frente a 45 en Alemania, 42 en Estados Unidos y unas 20 en Francia al mismo tiempo). El país apunta a dividir el costo de producción en más de tres antes de 2030, luego en un 80% antes de 2050. Entre 2013 y 2017, el estado japonés ya ha invertido $ 1.5 mil millones en I + D y desarrollo de hidrógeno.
En CaliforniaEn octubre de 2019, California tiene 7.570 coches de hidrógeno registrados y 42 estaciones públicas de EE. UU.
En AlemaniaEl gobierno alemán adopta un ambicioso plan para el desarrollo de hidrógeno "verde", dotado con 9.000 millones de euros.
Motor de hidrógeno
Fusión nuclear: bomba de H y reactores de fusión
Peligros, riesgos y precauciones
El dihidrógeno es un gas clasificado como "extremadamente inflamable ". Se caracteriza por un rango de inflamabilidad muy amplio (del 4 al 75% del volumen en aire), provocando una deflagración por una entrada de energía de activación muy baja (una chispa es suficiente si proporciona una energía de 0,02 milijulios (mJ) mientras se necesitan 0,29 mJ para provocar una explosión de metano ). El dihidrógeno mezclado con oxígeno en proporciones estequiométricas es un poderoso explosivo . Dihidrógeno en el aire es un explosivo mezcla cuando el H 2 / aire relación en volumen es de entre 13 y 65%
La historia de su uso en aeronaves está plagada de accidentes graves, el más famoso de los cuales es el desastre de Hindenburg . El zepelín LS 129 , inflado con 200.000 metros cúbicos de hidrógeno (porque Estados Unidos había declarado un embargo contra Alemania por el helio ) quemó el6 de mayo de 1937al llegar al aeródromo de Lakehurst , cerca de Nueva York ). Murieron 36 personas del total de 97 embarcadas. Los medios de comunicación presentes dieron a conocer ampliamente las imágenes del desastre, lo que provocó el descontento del público con los globos. Las investigaciones sobre el origen del accidente, facilitadas por la abundancia de documentos fotográficos, no incriminaron sin embargo una explosión de hidrógeno, sino una ignición por contigüidad, por un incendio en la envolvente (probablemente provocado por descarga de electricidad estática). La composición del revestimiento impermeable de la envoltura (butiratos y aluminio) habría favorecido una violenta reacción aluminotérmica . Sin embargo, el accidente habría sido mucho menos violento si el globo se hubiera inflado con helio.
El reemplazo del hidrógeno por helio (mucho más caro y denso) no produjo el esperado resurgimiento del favor. El miedo al hidrógeno permaneció; el "síndrome de Hindenburg" probablemente ha penalizado injustamente a la industria.
El dihidrógeno reacciona aún más violentamente con el cloro para formar ácido clorhídrico (HCl), incluso sin activación, y con difluoruro para formar ácido fluorhídrico (HF) peligroso, incluso a temperaturas en las que el hidrógeno es líquido y el flúor sólido, siendo esta última reacción la sustancia química más exotérmica. reacción hay .
Se refuerzan las normas de seguridad para hacer frente a los riesgos que plantea el paso en túneles y aparcamientos en garajes o aparcamientos subterráneos.
Las regulaciones de vehículos globales se están desarrollando bajo los auspicios de la ONU basadas en propuestas de los fabricantes, pero con respecto al dihidrógeno, los fabricantes japoneses, estadounidenses y europeos no están de acuerdo. La Comisión Europea podría decidir sobre reglamentos comunitarios provisionales.
En Francia, INERIS y CEA trabajan con la Organización Internacional de Normalización ( ISO ) en un comité técnico denominado TC 197 sobre el riesgo del hidrógeno. Un proyecto europeo Hysafe también aborda el tema, donde INERIS criticó el proyecto de reglamento al proponer un enfoque más global y sistémico y no por componentes para la homologación de vehículos híbridos . En 2015, MEDDE elaboró una actualización de la normativa para gasolineras y flotas de vehículos que funcionan con hidrógeno.
Peligro de la capa de ozono
Una liberación masiva de gas hidrógeno ha planteado la hipótesis de un riesgo para la capa de ozono .
Medidas de seguridad
Los siguientes puntos son notables:
- el hidrógeno no es inherentemente tóxico;
- es ocho veces más ligero que el metano. Su muy pequeña molécula le confiere un muy buen coeficiente de difusión en el aire (cuatro veces el del metano); en un ambiente no confinado, el hidrógeno tiende a elevarse y diluirse rápidamente en el aire (es un factor de seguridad al aire libre y un factor de peligro en lugares confinados);
- es la especie química más energética por unidad de masa (120 kJ / g ); pero por unidad de volumen de gas, la energía explosiva teórica es 3,5 veces menor para el hidrógeno que para el gas natural;
- su límite inferior de ignición es del 4% en volumen, comparable al del gas natural (5% en volumen); pero su límite superior de inflamación es significativamente más alto (75% contra 15%); esto significa que, en caso de fuga, el hidrógeno se encenderá con mucha más facilidad que el gas natural o los combustibles líquidos;
- la energía requerida para encenderlo en estequiometría también es significativamente menor (aproximadamente 10 veces) que el gas natural o el propano;
- la llama de hidrógeno, azul pálido, es casi invisible durante el día (riesgo para los servicios de emergencia);
- la llama de hidrógeno se propaga unas siete veces más rápido que la del gas natural y el riesgo de detonación (explosión con un efecto de explosión muy fuerte) se ve agravado por su alto coeficiente de difusividad.
La inflamabilidad se puede reducir aún más diluyendo hidrógeno en helio, incluso a temperaturas muy altas.
Referencia de la ONU para el transporte de mercancías peligrosas
- Nombre (francés): hidrógeno comprimido
- Clase 2
- número: 1049
- Nombre (francés): hidrógeno líquido refrigerado
- Clase 2
- número: 1966
- Nombre (inglés): hidrógeno en un dispositivo de almacenamiento de hidruro metálico
- Clase 2
- número: 3468
Notas y referencias
- HYDROGENE , la seguridad de hoja (s) del Programa Internacional para la Seguridad de Sustancias Químicas , consultado el 9 de mayo, 2009
- masa molecular calculada de " pesos atómicos de los elementos 2007 " en www.chem.qmul.ac.uk .
- (en) David R. Lide, CRC Handbook of Chemistry and Physics , CRC Press Inc,2009, 90 ª ed. , 2804 p. , Tapa dura ( ISBN 978-1-4200-9084-0 ).
- Jean-Louis Vignes ( dir. Y miembro de la Sociedad Química de Francia) et al. , " Dihydrogen: Physico-Chemical Data " , sitio educativo y de promoción relacionado con los elementos químicos (de la tabla periódica de Dmitri Mendeleïev ), en lelementarium.fr , Paris & Puteaux , Société Chimique de France & France Chimie (consultado el 3 de noviembre de 2019 ) .
- Pierre Ravarini (ingeniero químico e hidrólogo), " Gaz-Hydrogen " , sitio de información científica, técnica y ecológica sobre el agua, Côte de Nacre ( Calvados ), 2019(consultado el 3 de noviembre de 2019 ) .
- (en) James E. Mark, Manual de propiedades físicas del polímero , Springer,2007, 2 nd ed. , 1076 p. ( ISBN 978-0-387-69002-5 y 0-387-69002-6 , leer en línea ) , pág. 294
- (en) Robert H. Perry y Donald W. verde , de Perry Ingenieros Químicos Handbook , EE.UU., McGraw-Hill,1997, 7 ª ed. , 2400 p. ( ISBN 0-07-049841-5 ) , pág. 2-50
- " Propiedades de varios gases " , en flexwareinc.com (consultado el 12 de abril de 2010 )
- Actas del Comité Internacional de Pesos y Medidas , 78 ª reunión, 1989, pp. T1-T21 (y p. T23-T42, versión en inglés).
- (en) W. M Haynes, Handbook of Chemistry and Physics , CRC, 2010-2011 91 ª ed. , 2610 p. ( ISBN 978-1-4398-2077-3 ) , pág. 14-40.
- (en) David R. Lide , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press,18 de junio de 2002, 83 ª ed. , 2664 p. ( ISBN 0849304830 , presentación en línea ) , p. 5-89
- Magalie Roy-Auberger, Pierre Marion, Nicolas Boudet, Gasificación del carbón , ed. Techniques of the Engineer, referencia J5200 , 10 de diciembre de 2009, p. 4
- " Oficina de Seguridad Radiológica, Química y Biológica (ORCBS) " (consultado el 16 de abril de 2009 )
- Reglamento CE n o 1272/2008 , 16 de Diciembre, 2008 [PDF] en EUR-Lex , p. 923 : Anexo VI, cuadro 3.1, número de índice .
- " Hidrógeno " en la base de datos de productos químicos Reptox de la CSST (organización de Quebec responsable de la seguridad y salud en el trabajo), consultado el 23 de abril de 2009
- "Hidrógeno" , en ESIS , consultado el 15 de febrero de 2009
- " El descubrimiento de fuentes de hidrógeno abre el camino a una nueva energía " , Le Monde .
- “ Hidrógeno natural, ¿una energía El Dorado? » , Sciences et Avenir .
- Experimentos de Lavoisier , en lavoisier.cnrs.fr
- " Energía de hidrógeno " , sobre el conocimiento de las energías ,30 de agosto de 2011(consultado el 10 de diciembre de 2019 ) (actualizado9 de abril de, el año 2015).
- rendimiento de la cadena de hidrógeno (hoja técnica), Ademe ,enero 2020( leer en línea [PDF] ).
- " Detección de emanaciones de hidrógeno natural mediante imágenes de satélite - Lanzamiento del proyecto sen4H2 " , en IFP Énergies nouvelles (consultado el 6 de abril de 2019 ) .
- “ Deep-sea mineral resources ” , en Ifremer (consultado el 28 de octubre de 2019 ) .El artículo presenta un mapa de los fondos marinos que muestra la distribución serpentina conocida a lo largo de las crestas.
- Sylvestre Huet , “ el hidrógeno nativo, una nueva fuente de energía? » , Sobre sciences.blogs.liberation.fr , Liberación ,23 de abril de 2013(consultado el 28 de octubre de 2019 ) .
- " Reacción del manto de agua de mar: formación de serpentinas " , en Ifremer (consultado el 28 de octubre de 2019 ) .
- " Síntesis de hidrógeno, metano e hidrocarburos en las profundidades marinas, hacia nuevos recursos energéticos ... " , en Ifremer (consultado el 28 de octubre de 2019 ) .
- " de hidrógeno, sí, pero el hidrógeno naturales " , en La Tribune ,28 de junio de 2018(consultado el 3 de octubre de 2020 ) .
- Hidrógeno natural: ¿una contribución al mix energético? , IFP Nuevas energías ,11 de abril de 2013.
- Julia Guélard , Caracterización de las emanaciones de hidrógeno natural en un contexto intracratónico: ejemplo de una interacción gas / agua / roca en Kansas (tesis doctoral en geoquímica), Universidad Pierre-et-Marie-Curie e IFP Énergies nouvelles ,2016( presentación en línea , leer en línea ).
- (en) J. Guélard , V. Beaumont , V. Rouchon y F. Guyot , " H2 natural en Kansas: ¿origen superficial de oro profundo? » , Geoquímica, Geofísica, Geosistemas , vol. 18, n o 5,3 de abril de 2017, p. 1841–1865 ( ISSN 1525-2027 , DOI 10.1002 / 2016GC006544 , resumen , leído en línea , consultado el 28 de octubre de 2019 ).
- Alain Prinzhofer, Eric Deville, Hidrógeno natural: ¿la próxima revolución energética? , Ed. Belin, 2015 ( ISBN 978-27011-83848 ) .
- J. Guélard y col. , “ H 2 natural en Kansas: ¿origen profundo o superficial? ", Geoquímica Geofísica Geosistemas ,abril de 2017( DOI 10.1002 / 2016GC006544 , presentación en línea , leer en línea [PDF] , consultado el 25 de octubre de 2109 ).
- (en) Isabelle Moretti, Emyrose Brouilly, Keanu Loiseau, Alain Prinzhofer Eric Deville, " Humos de hidrógeno en áreas intraratónicas: nuevas líneas de guía para la exploración temprana de cuencas " en hmdpi.com ,22 de marzo de 2021(consultado el 16 de junio de 2021 )
- (in) Maria Rosanne Fabian Rupin Louis Gorintin Julio Aguilar, Helena-Fog, Werly Julien Olivier Lhote, Xi Yao, " EL SISTEMA PARHYS: UN NUEVO ENFOQUE PARA LAS MEDIDAS DE CONCENTRACIÓN H2 EN EL SUBSUPERFICIE " en hnatsummit.com ,26 de abril de 2021(consultado el 16 de junio de 2021 )
- (in) H. Hosgormez G. Etiope y MN Yalçin , " Nueva evidencia de un origen inorgánico y orgánico mixto de la quimera del fuego olímpico (Turquía): una filtración de gas abiogénico en la costa ancha " , Geofluids , vol. 8, n o 4,25 de noviembre de 2008, p. 263–273 ( DOI 10.1111 / j.1468-8123.2008.00226.x ).
- " Bourakébougou: la promesa de una planta de energía de hidrógeno " ,18 de febrero de 2013(consultado el 28 de octubre de 2019 ) .
- " Hidrógeno según Isabelle Moretti - Sciences et Avenir " , Sciences et Avenir (consultado el 2 de junio de 2021 ) .
- (in) "Gases volcánicos: quema de hidrógeno en el volcán Kilauea, Hawaii" en mendeley.com.
- (en) Deep Hydrogen en astrobio.net.
- (en) GJ MacDonald (1988). “Preguntas importantes sobre estructuras continentales profundas” Perforación profunda en lecho rocoso cristalino, v. 1 : 28-48 p., Berlín: Springer-Verlag. .
- " El hidrógeno natural es una fuente mucho más importante de lo que se pensaba según el CNRS " , en http://erh2-bretagne.mystrikingly.com ,11 de mayo de 2019(consultado el 12 de noviembre de 2019 ) .
- Isabelle Moretti, " hidrógeno Natural:? Curiosidad geológica o mayor fuente de energía en el futuro" » , Sobre el conocimiento de las energías .
- " El 15 de abril de 1988, el Tu-155 vuela con hidrógeno " , en Aerobuzz ,2 de octubre de 2020(consultado el 12 de noviembre de 2020 )
- hidrógeno, nuevas tecnologías energéticas. Las claves CEA, n o 50/51, invierno 2004-2005, ( ISSN 0298-6248 )
- Informe StorHy del proyecto europeo, p. 8, tasa de pérdida de hidrógeno
- Tribune article Europe financia una batería gigante para almacenar energía renovable
- (en) T. Mitsui, MK Rose E. Fomin, DF Ogletree y M. Salmeron, " La adsorción de hidrógeno disociativo es que el paladio requiere agregados de tres o más vacantes " , Nature , vol. 422,17 de abril de 2003, p. 705-707 ( DOI 10.1038 / nature01557 , leer en línea [PDF] ).
- (en) El futuro de Hidrógeno - Aprovechar las oportunidades de hoy [PDF] , la Agencia Internacional de la Energía , junio de año 2019.
- (in) Vías de descarbonización de gas 2020-2050 , Gas para el clima,abril 2020, 226 p. ( leer en línea [PDF] ) , pág. 17.
- " Plan de recuperación: ¿qué lugar para la energía? » , En connancedesenergies.org ,4 de septiembre de 2020.
- (in) " El hidrógeno producido a partir de energía nuclear se considerará 'bajo en carbono', un funcionario de la UE dice " ["El hidrógeno producido a partir de energía nuclear se considerará" baja huella de carbono ", según un funcionario de la UE»], en EURACTIV ,19 de noviembre de 2020.
- " El plan francés del hidrógeno confirma discretamente el relanzamiento de la energía nuclear " , en Reporterre ,2 de febrero de 2021.
- " Hidrógeno natural: ¿una curiosidad geológica o una importante fuente de energía en el futuro?" » , En connancedesenergies.org ,22 de mayo de 2020.
- “ Hidrógeno verde, el eslabón perdido en la transición ” , Alternatives économique (consultado el 8 de agosto de 2020 ) .
- Interacciones (carta a los accionistas de Air Liquide), Air Liquide , septiembre de 2015 [PDF] , p. 5 .
- (en) Liz Gyekye [ https://biomarketinsights.com/australia-backs-tech-that-converts-biogas-into-hydrogen-and-graphite/ "Australia respalda la tecnología que convierte el biogás en hidrógeno y grafito"] Vistas de biomarketing , 4 de septiembre de 2019.
- Jérôme Marin, " Lhyfe producirá hidrógeno verde con turbinas eólicas " , La Tribune ,17 de enero de 2020.
- "The Ademe enumera las" principales contribuciones "del hidrógeno a la transición energética" , Connaissance des energies , 4 de abril de 2018.
- El vector del hidrógeno en la transición energética , Opinión de ADEME, abril de 2018 [PDF] .
- Séverine Fontaine, " El Ademe quiere hidrógeno a partir de energías renovables ", L'Automobile y L'Entreprise , n o 5,febrero de 2016( leer en línea ).
- " La Comisión Europea presenta su plan de desarrollo de hidrógeno verde " , en EnerGeek ,10 de julio de 2020(consultado el 11 de julio de 2020 ) .
- Hidrógeno en la transición energética , Ademe , febrero de 2016, 7 páginas [PDF] .
- Joseph Martin , " Desarrollo de hidrógeno, ADEME hace balance " , en RSE Magazine (consultado el 17 de mayo de 2019 ) .
- "Los investigadores de Grenoble optimizan la fotosíntesis artificial para producir hidrógeno " , en placegrenet.fr ,21 de abril de 2018(consultado el 30 de marzo de 2019 ) .
- Véronique Pouzard, " La electrólisis de alta temperatura del CEA llevada a cabo por la start-up Sylfen " , Les Échos ,26 de febrero de 2019(consultado el 30 de marzo de 2019 ) .
- AFP (2019) Hidrógeno “verde”: cooperación entre Air Liquide, Engie y la aglomeración Durance, Lubéron, Verdon ; 13 de nov. De 2019
- McPhy en el centro de la unidad de producción de hidrógeno sin carbono más grande de Europa , Les Échos , 22 de enero de 2020.
- Plan de recuperación: Francia cambia de escala en hidrógeno , Les Échos , 3 de septiembre de 2020.
- Hidrógeno: Francia detalla su plan a 7 mil millones de euros , Les Échos , 8 de septiembre de 2020.
- Hidrógeno: el gobierno quiere crear un "Airbus para electrólisis" , Les Échos , 8 de septiembre de 2020.
- (in) "Los científicos de KU Leuven descifran el código para obtener gas hidrógeno asequible y ecológico " , en KU Leuven (consultado el 31 de octubre de 2019 ) .
- " Los investigadores belgas están desarrollando un panel solar que produce hidrógeno " , en RTBF Info ,1 st de marzo de 2019(consultado el 31 de octubre de 2019 ) .
- " Grupo Colruyt: la apuesta por la movilidad del hidrógeno " , en RTBF Info ,8 de octubre de 2018(consultado el 31 de octubre de 2019 ) .
- " Colruyt y Fluxys quieren construir una planta de hidrógeno, la primera en Bélgica " , Le Soir ,8 de octubre de 2019(consultado el 31 de octubre de 2019 ) .
- " Conducir con hidrógeno: nuestra experiencia " , automóvil Le Moniteur (consultado el 31 de octubre de 2019 ) .
- (en) Mónica Nagashima (Instituto de Economía Energética, Japón), la estrategia de hidrógeno de Japón y sus consecuencias económicas y geopolíticas , Instituto Francés de Relaciones Internacionales , octubre 2018 [PDF] .
- "La" estrategia del hidrógeno "de Japón" , Conocimiento de las energías, 9 de octubre de 2018.
- (en) " Alternative Fuels Data Center: Hidrógeno estación de combustible de vacaciones " , en los combustibles alternativos Data Center , Departamento de Energía de Estados Unidos (acceso 31 de de octubre de 2019 ) .
- Benoît Le Floc'h, “ ¿Qué pasa con el hidrógeno para vehículos comerciales ligeros? » , Sobre Caradisiac ,29 de noviembre de 2018(consultado el 30 de marzo de 2019 ) .
- " California supera el hito de 7500 coches de hidrógeno en circulación " , en www.h2-mobile.fr (consultado el 31 de octubre de 2019 ) .
- (in) " El gobierno alemán adopta una estrategia de hidrógeno " ["El gobierno alemán adopta una estrategia sobre el hidrógeno"], sobre el gobierno federal (Alemania) ,10 de junio de 2020.
- Accidentalología del hidrógeno , Ministerio de Ecología, Energía, Desarrollo Sostenible y Ordenación del Territorio , 18 p. ( leer en línea [PDF] ) , pág. 4.
- Radisson, Laurent (2015) Riesgos de hidrógeno: el Ministerio de Ecología está trabajando en nuevos textos; ; News env, publicado el 21 de octubre de 2015
- T. Rahn, JM Eiler, KA Boering, PO Wennberg, MC McCarthy, S. Tyler, S. Sc Chauffage, S. Donelly, E. Atlas, Enriquecimiento extremo de deuterio en hidrógeno estratosférico y el presupuesto atmosférico global de H2 , Naturaleza 424 , 918-921, 2003.
- TK Tromp , RL Shia , Mr. Allen , JM Eiler y YL Yung , " Potencial impacto ambiental de una economía del hidrógeno en la estratosfera " , Ciencia , n o 300,2003, p. 1740-1742 ( DOI 10.1126 / science.1085169 ).
- Céline Duguey, " An explosive experience " , en Espace des sciences ,septiembre de 2009(consultado el 16 de abril de 2020 ) .
- (in) Florent Tonus Mona Bahout , Paul F. Henry y Siân E. Dutton , " Uso de difracción in situneutron para monitorear reacciones de alta temperatura, sólido / H2-gas " , Chemical Communications , n o 18,21 de abril de 2009, p. 2556-2558 ( ISSN 1364-548X , PMID 19532888 , DOI 10.1039 / B822419F , leído en línea , consultado el 16 de abril de 2020 ).
Ver también
Bibliografía
- Yver, Camille, Cuantificación del uso de hidrógeno por los suelos: de la escala local a la global , 2011 DOI: 10.4267 / 2042/47372 ( resumen - Prix Prud'homme 2011.
- Stephen Boucher, La revolución del hidrógeno. ¿Hacia una energía limpia y eficiente? , prefacio de Thierry Alleau, París, Éd. du Felin, 2006, 160 p. , ( ISBN 2-86645-616-5 ) .
- Alain Prinzhofer, Eric Deville, Hidrógeno natural: ¿la próxima revolución energética? , Belin, 2015 ( ISBN 978-27011-83848 )
Artículos relacionados
enlaces externos
- Asociación Francesa de Hidrógeno
- Red europea / Polo de competencia
- Desarrollo H2
- CEA Technologies, Hydrogen, new energy technologies , Clefs CEA n o 50-51), 23 de marzo de 2005
- Hidrógeno visto por la CEA
- INERIS: retroalimentación de experiencias relacionada con las dificultades de almacenamiento
- Hidrógeno visto por la Sociedad Francesa de Química
- La controversia sobre el uso del hidrógeno como combustible
- Todo sobre la Alternativa del Hidrógeno, con reseña de prensa, enlaces de Internet y videos








