Ácido láctico
| Ácido láctico | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
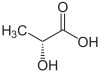
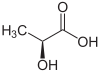
| Enantiómero R del ácido láctico (arriba, izquierda), ácido S-láctico (arriba, derecha) y estructura tridimensional del ácido S-láctico (abajo). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificación | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nombre IUPAC | Ácido 2-hidroxipropanoico | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS |
(RS) (S+ o L) (R- o D) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.000.017 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o EC | 200-018-0 209-954-4 ( RS ) 201-196-2 ( S ) 233-713-2 ( R ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Código ATC | G01 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o E | E270 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FEMA | 2611 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sonrisas |
CC (O) C (= O) O , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = InChI = 1 / C3H6O3 / c1-2 (4) 3 (5) 6 / h2,4H, 1H3, (H, 5,6) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Líquido viscoso de incoloro a amarillo o cristales de incoloro a amarillo (DL) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades químicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fórmula |
C 3 H 6 O 3 [Isómeros] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa molar | 90.0779 ± 0.0037 g / mol C 40%, H 6.71%, O 53.29%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | 3,86 ( 20 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fusión |
D / L : 16.8 ° C L : 53 ° C D : 53 ° C |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° hirviendo | 122 ° C ( 12 mmHg ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilidad | ligeramente molido. en éter ; insol. en cloroformo , éter de petróleo , disulfuro de carbono |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscibilidad | miscible con agua , alcohol , glicerol y furfuraldehído , un sol. alcohol-éter | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 1,248 5 g cm −3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| punto de inflamabilidad | 110 ° C (vaso cerrado) (DL) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termoquímica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p |
ecuación:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades ópticas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Índice de refracción | 1,4414 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poder rotatorio |
−2,6 ° ( 80 g l −1 , R) + 2,6 ° ( 25 g l −1 , S) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Precauciones | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ácido láctico: Producto no clasificadoLa clasificación de este producto aún no ha sido validada por la divulgación del servicio de directorio toxicológico al 1.0% de acuerdo con la lista de divulgación de ingredientes. Ácido láctico, (dl-): E,  E : material corrosivo ácido fuerte (pH calculado = 1,9 para una solución al 9%) Divulgación al 1,0% de acuerdo con la lista de divulgación de ingredientes |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Directiva 67/548 / CEE | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Xi Símbolos : Xi : Irritante Frases R : R38 : Irrita la piel. R41 : Riesgo de lesiones oculares graves. Frases S : S26 : En caso de contacto con los ojos, lávense inmediata y abundantemente con agua y acúdase a un médico. S39 : Use protección para los ojos / la cara. Frases R : 38, 41, Frases S : 26, 39, |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Compuestos relacionados | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isómero (s) | Ácido 3-hidroxipropanoico | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unidades de SI y STP a menos que se indique lo contrario. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El ácido láctico es un ácido orgánico que interviene en diversos procesos bioquímicos . El lactato es la base conjugada de este ácido (es decir, la forma ionizada del ácido láctico). Al contrario de lo que su nombre podría sugerir, el ácido láctico no está presente solo en la leche de la que fue extraído por primera vez por el químico sueco Carl Wilhelm Scheele . También se encuentra en el vino , determinadas frutas y verduras , en células animales donde está disociado y presente en forma de lactato así como en determinadas preparaciones ( chucrut, etc.).
El ácido láctico es un α-hidroxiácido , su fórmula bruta es C 3 H 6 O 3 y su estructura se refleja en su nombre sistemático, ácido 2-hidroxipropanoico.
Química
El átomo de carbono 2 que lleva el grupo hidroxi está haciendo quiral asimétricamente la molécula de ácido láctico . Por tanto, está en forma de dos enantiómeros :
- Ácido ( R ) -láctico o D (-) - ácido láctico;
- ( S ) -ácido láctico o L (+) - ácido láctico.
En solución , el grupo carboxilo -COOH puede perder un ion H + . Así, el ácido láctico (C 3 H 6 O 3 ) se transforma en ión lactato : CH 3 CHOHCOO -.
Por otro lado, en el músculo, se agregan dos iones H + al piruvato (C 3 H 3 O 3 ) para formar lactato (C 3 H 5 O 3 2+ ) .
El ácido láctico es soluble en agua y se considera un ácido débil ( pKa = 3,90), es decir, la reacción de disociación en agua no es completa:
CH 3 CHOHCOOH+ H 2 O⇄ CH 3 CHOHCOO -+ H 3 O +Por tanto, el ácido láctico se encuentra tanto en solución como en su forma básica, el ión lactato, en proporciones variables según el pH .
Esfuerzo muscular y fermentación láctica
El ácido láctico es uno de los productos clave en la producción de energía en los músculos en particular. La respiración celular (consumo de azúcares para producir energía) se puede dividir en dos etapas principales, la primera es la glucólisis , la parte citoplasmática del proceso, que tiene lugar en ausencia de oxígeno. Aporta piruvato, que suministra la segunda parte mitocondrial de la respiración celular ( ciclo de Krebs y fosforilación oxidativa) que da como resultado la reducción de oxígeno en el agua. En un extremo de la cadena se oxida la glucosa y en el otro se reduce el oxígeno. La energía liberada es recuperada por la célula.
Si el suministro de oxígeno es mayor que el consumo de azúcar, entonces todo el ácido pirúvico producido se consume inmediatamente en la parte mitocondrial.
Si el consumo de azúcar es mayor que el suministro de oxígeno (esfuerzos intensos) entonces parte del ácido pirúvico producido en la primera parte del proceso se reduce a ácido láctico, lo que permite que continúe el ciclo oxidativo de la glucólisis. Es una fermentación . La parte mitocondrial está saturada y el rendimiento energético se reduce considerablemente. Sin embargo, esta teoría del consumo de azúcar / consumo de oxígeno se cuestiona. En cuanto al rendimiento de energía anaeróbica, parece proporcionalmente más alto que el rendimiento de energía aeróbica, al contrario de lo que generalmente se acepta.
El lactato atraviesa la membrana celular para ingresar al torrente sanguíneo. El hígado , los músculos esqueléticos, el corazón y el cerebro pueden utilizar este sustrato para obtener energía. El hígado lo recicla en lo que se llama gluconeogénesis que resintetizará la glucosa mientras que otra parte es oxidada por el miocardio, así como por los músculos menos solicitados por el esfuerzo deportivo. El lactato se metaboliza aproximadamente una hora después del ejercicio sin ninguna actividad deportiva posterior al ejercicio, es decir, mucho antes de la aparición de la rigidez muscular , por lo que no es responsable.
Fermentación bacteriana
Hay dos tipos principales de fermentación bacteriana que producen ácido láctico: en el vino y los productos lácteos.
- En el vino , esta es la fermentación maloláctica : el ácido málico, contenido naturalmente en el vino, se descompone en ácido láctico bajo la acción de las bacterias.
- En la leche y los productos lácteos, el ácido láctico proviene de la descomposición de la lactosa por parte de las bacterias. Cuanto más fresca es la leche, menos ácido láctico contiene. La concentración de ácido láctico en la leche se expresa en grado Dornic (° D): 1 ° D corresponde a 0,1 g de ácido láctico por litro de leche. A la leche fresca contiene de 15 a 18 ° D , se codorniz a 60 - 70 ° D .
Los organismos responsables de la aparición del ácido láctico son los lactobacilos . Cuando operan en la boca, el ácido láctico producido puede provocar caries .
Este modo de fermentación láctica también ocurre en ciertas verduras ( repollo = chucrut y otras verduras llamadas "lacto-fermentadas"). El ácido láctico utilizado como AHA en cosmética no se extrae de la leche sino, por ejemplo, del azúcar de la remolacha , los arándanos , etc.
Usos
Fuente.
Directamente en la alimentación humana
El ácido láctico se utiliza en la industria alimentaria como aditivo (E270) como antioxidante , acidulante o potenciador del sabor . El ácido láctico también está presente en forma de sales: sal de sodio ( E325 ), potasio ( E326 ) y calcio ( E327 ). Estas sales están en forma de polvo y también son solubles en agua. Actúa como agente bacteriostático en particular sobre bacterias patógenas como la salmonella (o listeria ) y también un efecto depresor de la actividad del agua .
Según una investigación realizada en Quebec, parecería que el ácido láctico es uno de los medios más naturales para prevenir el cáncer de vejiga , pero también el de la piel .
En cosmética
Este ácido a veces se usa como parte de un peeling estético, en particular para pieles teñidas (las gamas de productos de decoloración estética están compuestos de ácido láctico); sin embargo, este ácido debe aplicarse bajo la supervisión de un dermatólogo y en condiciones de dosificación y dilución específicas según el tipo de tono de piel del paciente.
Como descontaminante y detergente
El ácido láctico ganó prominencia en la industria de los detergentes después de la década de 2000. Es un buen descalcificador , removedor de jabón y agente antibacteriano. También es económicamente ventajoso y es parte de una tendencia hacia ingredientes más seguros y más naturales para el medio ambiente. Por tanto, el ácido láctico se utiliza en los Estados Unidos para la descontaminación bacteriana de las canales bovinas en los mataderos . La carne de vacuno sujeta a esta práctica inicialmente prohibida por la Unión Europea , porque el uso de ácido láctico está aquí para corregir una falta de higiene ligada a prácticas laxas de tala. Como parte del compromiso sobre la importación de carne de vacuno norteamericano a Europa tras el embargo de hormonas de vacuno , este uso fue finalmente autorizado tras la publicación del reglamento europeo 101/2013 desde el principio.febrero de 2013. En Europa, esta práctica es, en principio, rastreable.
Precursor de plástico
El ácido láctico se polimeriza para dar ácido poliláctico (PLA), un material plástico biodegradable utilizado en particular para impresoras 3D , envasado de alimentos y cirugía .
Histórico
El ácido láctico fue descubierto por Carl Wilhelm Scheele (1742-1786).
Comercio
Francia, en 2014, es un importador neto de ácido láctico, según la aduana francesa. El precio medio de importación por tonelada fue de 1.400 euros.
Notas y referencias
- ácido láctico, la seguridad de hoja (s) de Programa Internacional de Seguridad Química , consultado el 9 de mayo, 2009
- " número de registro CAS: 50-21-5 " , en ntp.niehs.nih.gov (visitada 14 de febrero 2010 )
- masa molecular calculada de " pesos atómicos de los elementos 2007 " en www.chem.qmul.ac.uk .
- (en) JG Speight y Norbert Adolph Lange, Handbook of Chemistry de Lange , Nueva York, McGraw-Hill ,2005, 16 ª ed. , 1623 p. ( ISBN 978-0-07-143220-7 , LCCN 84643191 ) , pág. 2,289
- (en) Carl L. Yaws, Manual de diagramas termodinámicos , vol. 1, Huston, Texas, Pub del Golfo. Co.,1996( ISBN 978-0-88415-857-8 , LCCN 96036328 )
- (en) Maryadele J. O'Neil, Ann Smith, Patricia E. Heckelman y Susan Budavári, The Merck Index: Una Enciclopedia de los productos químicos, medicamentos y productos biológicos , Estados Unidos, Merck,2001, 13 ª ed. , 2564 p. ( ISBN 978-0-911910-13-1 )
- " Ácido láctico " en la base de datos de productos químicos Reptox de la CSST (organización de Quebec responsable de la seguridad y salud ocupacional), consultado el 24 de abril de 2009
- " Ácido láctico, (dl-) " en la base de datos de productos químicos Reptox de la CSST (organización de Quebec responsable de la seguridad y salud ocupacional), consultado el 25 de abril de 2009
- " Ácido láctico " , en societechimiquedefrance.fr (consultado el 18 de septiembre de 2019 )
- (en) George A. Brooks , " La ciencia y la traducción de la teoría de la lanzadera de lactato " , Metabolismo celular , vol. 27, n o 4,abril 2018, p. 757–785 ( ISSN 1550-4131 , DOI 10.1016 / j.cmet.2018.03.008 , leído en línea , consultado el 30 de mayo de 2018 )
- Luc Léger , Georges Cazorla , Cyril Petibois y Laurent Bosquet , “ Lactato y ejercicio: mitos y realidades ”, Staps , vol. No. 54, n o 1,2001, p. 63–76 ( ISSN 0247-106X , DOI 10.3917 / sta.054.0063 , leído en línea , consultado el 30 de mayo de 2018 )
- Pascal Prevost, " Courbatures " , en Sciensport ,2006(consultado el 8 de enero de 2008 )
- UN Wiesmann , S. DiDonato y NN Herschkowitz , “ Efecto de la cloroquina en fibroblastos cultivados: liberación de hidrolasas lisosomales e inhibición de su captación ”, Comunicaciones de investigación bioquímica y biofísica , vol. 66, n o 4,27 de octubre de 1975, p. 1338-1343 ( ISSN 1090-2104 , PMID 4 , leer en línea , visitada 1 st 04 2018 )
- C. Chêne (2002), ácidos orgánicos [PDF] , Centro de Recursos tecnológico para las empresas agroalimentarias, http://www.adrianor.com .
- http://sante.canoe.com/channel_health_news_details.asp?channel_id=2001&relation_id=3483&news_channel_id=2001&news_id=3695
- Preguntas y respuestas en el Senado
- " Indicador de comercio de importación / exportación " , en Dirección General de Aduanas. Indique NC8 = 29181100 (consultado el 7 de agosto de 2015 )
Ver también
Artículos relacionados
- Aditivo alimentario
- Aroma
- Leche y vino
- Ácido poliláctico , polímero biodegradable
enlaces externos
- [video] "Molecular Mojito - Molecular Cocktail - Molecular Cuisine - Molecular Gastronomy" en YouTube ,15 de noviembre de 2016.
Bibliografía
- Ackerman SH y Sachar EJ (1974), La teoría del lactato de la ansiedad: una revisión y reevaluación , Psychosom. Medicina. , Enero-febrero de 1974, 36 (1), 69-81.





