Diciclohexilcarbodiimida
| Diciclohexilcarbodiimida | |||
 
|
|||
| Identificación | |||
|---|---|---|---|
| Nombre IUPAC | N, N'-diciclohexilmetanodiimina | ||
| Sinónimos |
N, N'-diciclohexilcarbodiimida |
||
| N o CAS | |||
| N o ECHA | 100,007,914 | ||
| N o EC | 208-704-1 | ||
| N o RTECS | FF2160000 | ||
| PubChem | 10868 | ||
| CHEBI | 53090 | ||
| Sonrisas |
C1CCC (CC1) N = C = NC2CCCCC2 , |
||
| InChI |
InChI: InChI = 1S / C13H22N2 / c1-3-7-12 (8-4-1) 14-11-15-13-9-5-2-6-10-13 / h12-13H, 1- 10H2 InChIKey: QOSSAOTZNIDXMA-UHFFFAOYSA-N |
||
| Apariencia | sólido incoloro con olor característico | ||
| Propiedades químicas | |||
| Fórmula bruta |
C 13 H 22 N 2 [Isómeros] |
||
| Masa molar | 206,3272 ± 0,0123 g / mol C 75,68%, H 10,75%, N 13,58%, |
||
| Propiedades físicas | |||
| T ° fusión |
34 a 35 ° C 34,5 a 37,0 ° C 35 a 36 ° C |
||
| T ° hirviendo |
122 a 124 ° C 122 a 124 ° C a 6 mmHg |
||
| Solubilidad | CH 2 Cl 2 sustancialmente insoluble en agua 0,1 g · ml -1 |
||
| Densidad | 0,95 g · cm -3 a 40 ° C | ||
| punto de inflamabilidad | 113 ° C | ||
| Precauciones | |||
| SGH | |||
  H302, H311, H317, H318, P280, P312, P305 + P351 + P338,
H302 : Nocivo en caso de ingestión
H302, H311, H317, H318, P280, P312, P305 + P351 + P338,
H302 : Nocivo en caso de ingestión H311 : Tóxico en contacto con la piel H317 : Puede provocar una reacción alérgica en la piel H318 : Provoca lesiones oculares graves P280 : Llevar guantes / ropa protectora / protección ocular / protección facial. P312 : Llame a un CENTRO DE INFORMACIÓN TOXICOLÓGICA oa un médico si no se encuentra bien. P305 + P351 + P338 : En caso de contacto con los ojos: Enjuagar cuidadosamente con agua durante varios minutos. Quítese los lentes de contacto si la víctima los está usando y se pueden quitar fácilmente. Continúe enjuagando. |
|||
| NFPA 704 | |||
| 1 3 0 | |||
| Transporte | |||
2811 : SÓLIDO TÓXICO, ORGÁNICO, NOS Clase: 6.1 Etiqueta: 6.1 : Material tóxico  |
|||
| Ecotoxicologia | |||
| DL 50 | 400 mg / kg (rata, oral ) | ||
| Unidades de SI y STP a menos que se indique lo contrario. | |||
La N, N'-diciclohexilcarbodiimida o DCC es un compuesto orgánico de la familia de las carbodiimidas que se utiliza principalmente como reactivo para el acoplamiento de aminoácidos en la síntesis de péptidos .
Síntesis
Se han desarrollado muchas rutas sintéticas, la más reciente a través de una reacción de acoplamiento ofrece mejores rendimientos. Históricamente, DCC se formó por deshidratación de la diciclohexil - urea por cloruro de paratoluenosulfonilo en presencia de trifenilfosfina y trietilamina como bases . De manera similar, la diciclohexil tiourea reacciona con el óxido de mercurio para formar un intermedio en el que el átomo de azufre es intercambiado por el oxígeno . Su deshidratación luego forma DCC:

En 1987, el uso de carbonato de potasio en lugar de trifenilfosfina y trietilamina como base y de un catalizador de transferencia de fase por parte del grupo de Zsuzsa Jaszay les permite obtener un rendimiento del 50%. Diciclohexilurea, cloruro de arenosulfonilo y carbonato de potasio reaccionar en tolueno en presencia de bencil trietil amonio cloruro para dar N, N'-diciclohexilcarbodiimida:
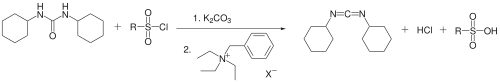
Ilan Pri-Bara y Jeffrey Schwartz utilizan acetato de paladio , yodo y oxígeno para acoplar ciclohexilamina e isocianuro de ciclohexilo . Se han obtenido rendimientos de hasta el 67% siguiendo esta ruta:
C 6 H 11 NH 2 + C 6 H 11 N≡C + O 2 → (C 6 H 11 N) 2 C + H 2 O.Equipo de condensación de Jiansheng Tang dos isocianatos utilizando el OP (Mench 2 CH 2 ) 3 N catalizador con un rendimiento del 92%:

Propiedades y caracterización
DCC es un polvo incoloro con un característico olor dulce y pesado. El bajo punto de fusión de este compuesto permite que se derrita para facilitar su manipulación. Es muy soluble en diclorometano , tetrahidrofurano , acetonitrilo y dimetilformamida , pero insoluble en agua.
El núcleo N = C = N de las carbodiimidas es lineal y está relacionado estructuralmente con los alenos (C = C = C). Tres estructuras de resonancia principales describen las carbodiimidas:
RN = C = NR ↔ RN + ≡CN - R ↔ RN - -C≡N + R.Este patrón N = C = N tiene una firma característica en espectroscopía IR a 2117 cm -1 . El espectro de RMN de 15 N muestra una característica de desplazamiento químico de 275,0 ppm campo arriba con respecto al ácido nítrico y el espectro de RMN de 13 C tiene un pico a aproximadamente 139 ppm corriente abajo del TMS .
Usar
DCC es un reactivo que se puede utilizar para deshidrataciones , esterificaciones y otras activaciones en condiciones muy suaves.
Deshidración
DCC es un agente deshidratante para la preparación de alquenos , nitrilos . En estas reacciones, DCC se hidrata para formar diciclohexilurea (DCU) que es insoluble en agua.
Por lo tanto, la deshidratación de los alcoholes procede dando primero el intermedio O-acil urea que luego se corta por hidrogenólisis para producir el alqueno correspondiente:
RCHOHCH2R '+ (C 6 H 11 N) 2 C → RCH = CHR' + (C 6 H 11 NH) 2 CO.Oxidación de Moffatt
Una solución de DCC en dimetilsulfóxido (DMSO) permite lo que se denomina oxidación de Pfitzner-Moffatt . Esta reacción se utiliza para la oxidación de alcoholes a aldehídos y cetonas. A diferencia de las oxidaciones a través de iones metálicos , las condiciones con DCC son lo suficientemente suaves como para evitar la sobreoxidación de aldehídos a ácidos carboxílicos . En general, se dejan durante la noche a temperatura ambiente tres equivalentes de DCC por 0,5 equivalentes de alcohol en DMSO. La reacción se detiene por acidificación.
Esterificación y amidación
El DCC se utiliza principalmente en la síntesis de ésteres y amidas orgánicas, en particular cuando los compuestos a reaccionar son impedidos o poco reactivos, permite un aumento significativo de los rendimientos. Además, realiza, a diferencia de la esterificación de Fischer, estas esterificaciones y amidaciones en condiciones muy suaves, lo que resulta muy ventajoso con compuestos poco nucleofílicos como el alcohol terc-butílico .
Por tanto, DCC también juega un papel importante en la síntesis de péptidos in vitro y en la introducción de grupos protectores .
Inversión de alcoholes secundariosLos alcoholes secundarios se pueden invertir estereoquímicamente mediante la formación de un éster de formilo , seguido de saponificación . El alcohol secundario se mezcla directamente con DCC, ácido fórmico y una base fuerte como el metóxido de sodio .
Esterificación SteglichSe puede esterificar una amplia gama de alcoholes, incluidos incluso algunos alcoholes terciarios, con un ácido carboxílico en presencia de DCC y una cantidad catalítica de 4-dimetilaminopiridina , DMAP.
De hecho, cualquier grupo carboxilo (> C = O) se suma rápidamente a uno de los dobles enlaces C = N de DCC, formando el correspondiente derivado de O-acil urea. Este intermedio es muy reactivo, siendo su reactividad comparable a la de un anhídrido de ácido , por lo que se convierte rápida y fácilmente en una amida por reacción con una amina . Para su acoplamiento con alcoholes, es necesario adicionalmente un agente de transferencia de acilo como DMAP . Esto se llama esterificación de Steglich. En resumen, el resultado de estas condensaciones del ácido unido a DCC con un alcohol o una amina es un éster o una amida respectivamente, y una molécula de agua capturada por el DCC que se convierte en N, N'-diciclohexil urea, (C 6 H 11 -NH) 2 C = O.
Acoplamiento de péptidos promovido por DCCDurante la síntesis de péptidos o proteínas (por ejemplo, mediante un sintetizador de estado sólido Fmoc ), el extremo N-terminal se usa a menudo como el sitio de unión al que se añaden los aminoácidos . Para mejorar la electrofilicidad del grupo carboxilato del aminoácido desprotonado que se va a añadir, el átomo de oxígeno cargado negativamente debe activarse primero en un mejor grupo saliente . DCC se utiliza para este propósito. El átomo de oxígeno cargado negativamente, que por lo tanto es nucleófilo ataca fácilmente al átomo de carbono central de DCC que, por lo tanto, está temporalmente unido al grupo carboxilato y forma un intermedio altamente electrófilo, lo que hace que el ataque nucleófilo por el grupo amino terminal del péptido sea mucho más efectivo .
seguridad
Además de ser tóxica, la diciclohexilcarbodiimida también tiene un fuerte efecto alérgeno y sensibilizante , que a menudo causa erupciones cutáneas .
Notas y referencias
- ( fr ) Este artículo está tomado parcial o totalmente del artículo de Wikipedia en inglés titulado " N, N'-Dicyclohexylcarbodiimide " ( consulte la lista de autores ) .
- (de) Este artículo está tomado parcial o totalmente del artículo de Wikipedia en alemán titulado “ Dicyclohexylcarbodiimid ” ( ver lista de autores ) .
- (es) " Diciclohexilcarbodiimida " , en ChemIDplus
- Entrada "Dicyclohexylcarbodiimid" en la base de datos química GESTIS de la IFA (organismo alemán responsable de la seguridad y salud en el trabajo) ( alemán , inglés ) (se requiere JavaScript)
- masa molecular calculada de " pesos atómicos de los elementos 2007 " en www.chem.qmul.ac.uk .
- N, N'-diciclohexilcarbodiimida ≥99,0% (GC) de Sigma-Aldrich .
- (de) R. Appel, R. Kleinstück, K.-D. Ziehn, Über die gemeinsame Einwirkung von Phosphinen und Tetrachlorkohlenstoff auf Ammoniak (Derivado), IV Notiz über eine neue Carbodiimid-Synthese , Chem. Ber. , 1971, vol. 104, pág. 1335-1336. DOI : 10.1002 / cber.19711040438 .
- (De) S. Hauptmann, J. Graefe, H. Remane, Lehrbuch der organischen Chemie ' , Deutscher Verlag für Grundstoffindustrie, Leipzig, 1976, p. 433.
- Zsuzsa Jaszay, Imre Petnehazy, Laszlo Toke, Bela Szajani, Preparación de carbodiimidas mediante catálisis de transferencia de fase , Síntesis , 1987, vol. 5 (5), pág. 520–523. DOI : 10.1055 / s-1987-27992 .
- Ilan Pri-Bara, Jeffrey Schwartz, síntesis de N, N-dialquilcarbodiimida por acoplamiento catalizado por paladio de aminas con isonitrilos , Chem. Común. , 1997, vol. 4 (4), pág. 347. DOI : 10.1039 / a606012i .
- Jiansheng Tang, Thyagarajan Mohan, John G. Verkade, selectivo y síntesis eficiente de Perhidro-1,3,5-triazina-2,4,6-trionas y carbodiimidas a partir de isocianatos El uso de ZP (Mench 2 CH 2 ) s catalizadores N . J. Org. Chem. , 1994, vol. 59 (17), pág. 4931-4938. DOI : 10.1021 / jo00096a041 .
- Issa Yavari, John D. Roberts, Espectroscopia de resonancia magnética nuclear de nitrógeno-15. Carbodiimidas . J. Org. Chem. 1978, vol. 43 (25), pág. 4689–4690. DOI : 10.1021 / jo00419a001 .
- H. Wiener, C. Gilon, Un método mejorado para la preparación catalítica de t-butil ésteres de ácidos carboxílicos y grasos , J. Mol. Catal. , 1986, vol. 37, pág. 45-52. DOI : 10.1016 / 0304-5102 (86) 85136-7 .
- B. Neises, W. Steglich, Esterificación de ácidos carboxílicos con diciclohexilcarbodiimida / 4-dimetilaminopiridina: fumarato de etilo de terc-butilo , Org. Synth. , coll. " Vuelo. 7 ",1990, p. 93
- B. Neises, W. Steglich, Método simple para la esterificación de ácidos carboxílicos , Angew. Chem. En t. Ed. , 1978, vol. 17, pág. 522–524. DOI : 10.1002 / anie.197805221 .
- R. Milcent y F. Chau, Química orgánica heterocíclica: Estructuras fundamentales, química y bioquímica de los principales compuestos naturales , EDP Sciences, 2003. ( ISBN 9782868835833 ) , presentación en línea
- EFV Scriven, 4-dialquilaminopiridinas: catalizadores de súper acilación y alquilación , Chem. Soc. Rvdo. , 1983, vol. 12, pág. 129-161.
