Ácido metanoico
| ácido metanoico | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fórmulas de Lewis y 3D para ácido metanoico | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificación | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nombre IUPAC | Ácido metanoico | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sinónimos |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.000.527 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CE | 200-579-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o E | E236 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FEMA | 2487 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sonrisas |
C (= O) O , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / CH2O2 / c2-1-3 / h1H, (H, 2,3) / f / h2H |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | líquido incoloro, ahumado, olor acre | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades químicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fórmula bruta |
C H 2 O 2 [Isómeros] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa molar | 46,0254 ± 0,0015 g / mol C 26,1%, H 4,38%, O 69,52%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | 3.751 ( 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Momento dipolar | 1,425 ± 0,002 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diámetro molecular | 0.381 nm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fusión | 8,3 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° hirviendo | 101 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilidad |
1000 g · l -1 (agua, 25 ° C ), |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parámetro de solubilidad δ |
24,8 MPa medio ( 25 ° C ); 21,4 J 1/2 · cm -3/2 ( 25 ° C ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
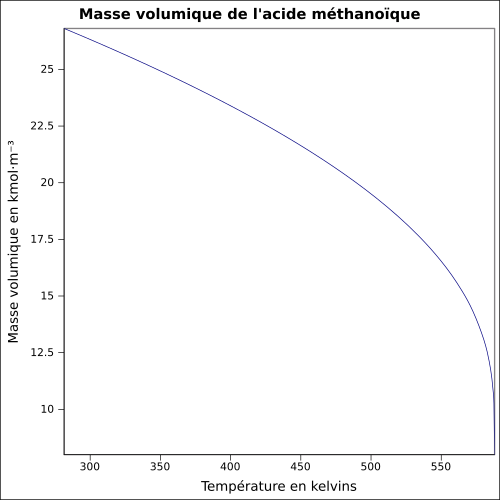
| Densidad | 1,22 a 25 ° C
ecuación:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura de autoignición | 520 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| punto de inflamabilidad | 69 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Límites explosivos en el aire | 14 - 34 % vol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor saturante |
42,6 mmHg ( 25 ° C )
ecuación:

|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Viscosidad dinámica | 1,57 × 10 -3 Pa s a 26 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto crítico | 306,85 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Triple punto | 281,45 K ( 8,3 ° C ) 23,6 mbar |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termoquímica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 gas, 1 bar | 248,7 J mol −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 líquido, 1 bar | 131,8 J mol −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 gas | −378,6 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 líquido | −425,1 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p |
45,7 J · mol -1 · K -1 (vapor) 99,0 J · mol -1 · K -1 (líquido) ecuación:
ecuación:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCS | 254,6 kJ · mol -1 ( 25 ° C , líquido) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades electronicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 re energía de ionización | 11,33 ± 0,01 eV (gas) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades ópticas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Índice de refracción | 1.3694 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Precauciones | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Peligro H226, H302, H314, H331, H226 : Líquido y vapores inflamables H302 : Nocivo en caso de ingestión H314 : Provoca quemaduras graves en la piel y lesiones oculares graves H331 : Tóxico por inhalación |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  B3, E, B3 : Punto de inflamación del líquido combustible = 46,5 ° C copa cerrada (método no informado) E : Material corrosivo Transporte de mercancías peligrosas: clase 8 Divulgación al 1,0% según la lista de divulgación de ingredientes |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 3 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transporte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1779 : ÁCIDO FÓRMICO |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inhalación | Los vapores concentrados son corrosivos | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ingestión | Tóxico, puede provocar reacciones alérgicas. Sospecha de agente mutagénico | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ecotoxicología | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DL 50 |
700 mg · kg -1 (ratón, oral ) 145 mg · kg -1 (ratones, iv ) 940 mg · kg -1 (ratones, ip ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | -0,54 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Umbral de olor | bajo: 1,6 ppm alto: 340 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unidades de SI y STP a menos que se indique lo contrario. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El ácido metanoico (también conocido como ácido fórmico ) es el ácido carboxílico más simple . Su fórmula química es C H 2 O 2 o HCOOH. Su base conjugada es el ion metanoato (formiato) con la fórmula HCOO - . Es un ácido débil que se presenta en forma de líquido incoloro con un olor penetrante.
En la naturaleza se encuentra en las glándulas de varios insectos del orden de los himenópteros , como abejas y hormigas , pero también en los pelos que forman las hojas de ciertas plantas de la familia de las urticáceas ( ortigas ). Su nombre fórmico trivial proviene de la palabra latina formica que significa hormiga, porque fue aislada por primera vez por destilación de hormigas.
Historia
Desde el XV ° siglo, algunos alquimistas y naturalistas eran conscientes de que algunas hormigas , especialmente el tipo Formica , produciendo un vapor de ácido . La primera persona que describió el aislamiento de esta sustancia (por destilación de un gran número de cadáveres de hormigas) fue el naturalista inglés John Ray en 1671. Su primera síntesis la hizo el químico francés Gay-Lussac a partir del ácido cianhídrico . En 1855, otro químico francés, Marcellin Berthelot , desarrolló un método de síntesis a partir de monóxido de carbono , similar al que se usa en la actualidad. El ácido fórmico está presente en la composición de la mayoría de venenos de hormigas, que lo rocían o lo aplican directamente para perforar la cutícula de otros artrópodos o repeler posibles depredadores .
Química
Propiedades reductoras
Calentado con ácido sulfúrico , el ácido fórmico se descompone en agua y monóxido de carbono , por lo que tiene propiedades reductoras muy marcadas (reducción de sales de oro , plata , cobre , etc.). Solo bajo la acción del calor, se descompone a alrededor de 160 ° C en hidrógeno y dióxido de carbono , lo que nuevamente resulta en propiedades reductoras.
Ácido débil
Aunque está más ionizado que sus homólogos de ácido carboxílico superior, es un ácido débil , pero a pesar de esto es capaz de desplazar el ácido nítrico de sus sales. Si se agrega ácido fórmico a una mezcla de nitrato de potasio y brucina , la mezcla se vuelve roja instantáneamente. No da ningún anhídrido de ácido y da como haluro de acilo equivalente el fosgeno COCl 2 .
Fabricación
Al calentar potasa y monóxido de carbono en un tubo sellado , Berthelot sintetizó ácido fórmico: CO + KOH → H-CO 2 K, luego, bajo una presión de 7 atm. ya 170 ° C , hidrólisis de formiato de potasio H-CO 2 K con ácido sulfúrico ; el producto obtenido por destilación a presión reducida contiene 80 a 85% de ácido fórmico.
Usos
El ácido metanoico se utiliza en las siguientes industrias: textiles ( tintes , tratamiento del cuero ), insecticidas , lacas , disolventes , curtido , galvanoplastia, fumigantes , alimentación humana ( aditivo alimentario E236). También se usa para platear espejos y para tratar verrugas.
También se utiliza en la apicultura como un medio complementario de control de la varroa . También se utiliza en descalcificadores (gel de baño).
Trazador biológico
Durante la intoxicación por metanol , este último se metaboliza primero en metanal por la acción de la alcohol deshidrogenasa , una enzima no específica que tiene una mejor afinidad con el etanol , y luego en ácido fórmico mediante la acción de la formaldehído deshidrogenasa . La última etapa consiste en la transformación en dióxido de carbono , etapa que limita la eliminación. A medida que el metanal se transforma rápidamente, se crea una acumulación de formato y es la causa de toxicidad ( acidosis metabólica ). La medición de formiatos en la orina puede detectar intoxicación por metanol.
La investigación del Instituto Leibniz de Catálisis en Rostock ha demostrado que se puede utilizar para el almacenamiento de hidrógeno para alimentar una pila de combustible .
En presencia de platino , es posible descomponer el ácido fórmico en hidrógeno y dióxido de carbono .
CH 2 O 2 → H 2 + CO 2En 2006, un equipo de investigación de EPFL (Suiza) presentó el uso de ácido fórmico como solución de almacenamiento de hidrógeno . Un sistema catalítico homogéneo, basado en una solución acuosa de catalizadores de rutenio, descompone el ácido fórmico HCOOH en dihidrógeno H 2 y dióxido de carbono CO 2 . Por tanto, se puede producir dihidrógeno en un amplio intervalo de presiones (1 - 600 bar ) y la reacción no genera monóxido de carbono . Este sistema catalítico resuelve los problemas de los catalizadores existentes para la descomposición del ácido fórmico (baja estabilidad, vida limitada del catalizador, formación de monóxido de carbono) y hace viable este método de almacenamiento de hidrógeno. El coproducto de esta descomposición, el dióxido de carbono, se puede utilizar en un segundo paso para generar nuevamente ácido fórmico por hidrogenación. La hidrogenación catalítica de CO 2 se ha estudiado en profundidad y se han desarrollado métodos eficientes.
El ácido fórmico contiene 53 g · l -1 de hidrógeno a temperatura y presión ambiente, que es el doble de la capacidad del hidrógeno comprimido a 350 bar . El ácido fórmico puro es un líquido inflamable con un punto de inflamación de + 69 ° C , que es más alto que la gasolina ( −40 ° C ) o el etanol (+ 13 ° C ). Diluido del 85%, ya no es inflamable. El ácido fórmico diluido está incluso en la lista de aditivos alimentarios de la Administración de Alimentos y Medicamentos (FDA).
Comercio
Francia es un importador neto de ácido fórmico, según la aduana francesa. El precio medio por tonelada importada fue de 600 €.
Detección fuera del sistema solar
En 2018, el radiotelescopio ALMA detectó ácido metanoico en el disco protoplanetario de la estrella TW Hydrae .
Notas y referencias
- ÁCIDO FORMICO, hoja (s) de datos de seguridad del Programa Internacional sobre Seguridad de Sustancias Químicas , consultado el 9 de mayo de 2009
- (en) " ácido metanoico " , en ChemIDplus , visitada 08 de febrero 2009
- (en) David R. Lide, Manual de química y física , CRC,16 de junio de 2008, 89 ª ed. , 2736 p. ( ISBN 142006679X y 978-1420066791 ) , pág. 9-50
- (en) Yitzhak Marcus, Las propiedades de los disolventes , vol. 4, Inglaterra, John Wiley & Sons Ltd,1999, 239 p. ( ISBN 0-471-98369-1 )
- masa molecular calculada de " pesos atómicos de los elementos 2007 " en www.chem.qmul.ac.uk .
- (en) James E. Mark, Manual de propiedades físicas del polímero , Springer,2007, 2 nd ed. , 1076 p. ( ISBN 0387690026 , leído en línea ) , pág. 294
- (en) Robert H. Perry y Donald W. verde , de Perry Ingenieros Químicos Handbook , EE.UU., McGraw-Hill,1997, 7 ª ed. , 2400 p. ( ISBN 0-07-049841-5 ) , pág. 2-50
- " Propiedades de varios gases " en flexwareinc.com (consultado el 12 de abril de 2010 )
- (en) Carl L. Yaws, Manual de diagramas termodinámicos , vol. 1, 2 y 3, Huston, Texas, Gulf Pub. Co.,1996( ISBN 0-88415-857-8 , 978-0-88415-858-5 y 978-0-88415-859-2 )
- (en) David R. Lide , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press,18 de junio de 2002, 83 ª ed. , 2664 p. ( ISBN 0849304830 , presentación en línea ) , p. 5-89
- (en) David R. Lide, Manual de química y física , CRC,2008, 89 ª ed. , 2736 p. ( ISBN 978-1-4200-6679-1 ) , pág. 10-205
- Ficha de seguridad publicada por Sigma-Aldrich, consultada el 5 de septiembre de 2020
- " Ácido fórmico " en la base de datos de productos químicos Reptox de la CSST (organización de Quebec responsable de la seguridad y salud en el trabajo), consultado el 24 de abril de 2009
- " ácido fórmico, " en hazmap.nlm.nih.gov (visitada 14 de noviembre 2009 )
- http://www.myrmecofourmis.fr/Jets-d-acide-formique-par-des-fourmis
- "¡ Mira cómo el veneno de estas hormigas hace burbujas!" » [Video] , en YouTube (consultado el 12 de septiembre de 2020 ) .
- Codex Alimentarius, " Nombres de grado y sistema internacional de numeración de aditivos alimentarios " , en http://www.codexalimentarius.net ,2009(consultado el 19 de mayo de 2010 )
- Beekeeper68, " Tratamiento de Varroa con ácido fórmico " , en http://same-apiculture.colinweb.fr/ ,18 de diciembre de 2010(consultado el 17 de agosto de 2017 )
- http://www.bulletins-electroniques.com/actualites/54627.htm
- Gábor Laurenczy, Céline Fellay, Paul J. Dyson, Producción de hidrógeno a partir del ácido fórmico. PCT Int. Apl. (2008), 36 págs. CODEN: PIXXD2 WO 2008047312 A1 20080424 AN 2008: 502691
- Céline Fellay, Paul J. Dyson, Gábor Laurenczy, Un sistema de almacenamiento de hidrógeno viable basado en la descomposición selectiva de ácido fórmico con un catalizador de rutenio, Angew. Chem. En t. Ed. , 2008 , 47 , 3966–3970.
- Ferenc Joó, Avances en el almacenamiento de hidrógeno: ácido fórmico como material de almacenamiento sostenible de hidrógeno, ChemSusChem 2008 , 1 , 805–808.
- PG Jessop, en Manual de hidrogenación homogénea (Eds.: JG de Vries, CJ Elsevier), Wiley-VCH, Weinheim, Alemania, 2007 , p. 489–511 .
- PG Jessop, F. Joó, C.-C. Tai, Avances recientes en la hidrogenación homogénea de dióxido de carbono, Coord. Chem. Rvdo. , 2004 , 248, 2425–2442.
- Código de Regulaciones Federales de EE. UU .: 21 CFR 186.1316, 21 CFR 172.515
- " Indicador de comercio de importación / exportación " , en Dirección General de Aduanas. Indique NC8 = 29151100 (consultado el 7 de agosto de 2015 )
- (en) Cécile Favre, Davide Fedele, Dmitry Semenov, Sergey Parfenov et al. , " Primera detección del ácido orgánico más simple en un disco protoplanetario " , The Astrophysical Journal Letters ,16 de julio de 2018( leer en línea ).