Hexafluorofosfato
| Hexafluorofosfato | |
|
|
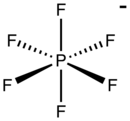
| Estructura y representación tridimensional del anión hexafluorofosfato | |
| Identificación | |
|---|---|
| N o CAS | |
| N o ECHA | 100,111,656 |
| N o EC | 605-543-2 |
| PubChem | 9886 |
| CHEBI | 30201 |
| Sonrisas |
F [P -] (F) (F) (F) (F) F , |
| InChI |
Std. InChI: InChI = 1S / F6P / c1-7 (2,3,4,5) 6 / q-1 Std. InChIKey: LJQLCJWAZJINEB-UHFFFAOYSA-N |
| Propiedades químicas | |
| Fórmula bruta | PF 6- |
| Masa molar | 144,964181 ± 0 g / mol F 78,63%, P 21,37%, |
| Unidades de SI y STP a menos que se indique lo contrario. | |
Los hexafluorofosfatos son compuestos químicos que contienen el anión de fórmula PF 6- , base conjugada del ácido hexafluorofosfórico HPF 6. Anión hexafluorofosfato PF 6- tiene una geometría octaédrica y es isoelectrónico con hexafluoruro de azufre SF 6y el dianión de hexafluorosilicato SiF 62– , así como con el anión fluoroantimoniato SbF 6- . El átomo de fósforo está presente en el estado de oxidación +5.
El anión hexafluorofosfato es débilmente nucleófilo y también tiene una débil coordinación . Es propenso a descomponerse liberando fluoruro de hidrógeno en líquidos iónicos, pero generalmente es muy estable en solución. La hidrólisis es muy lenta, incluso en concentrados ácidos calentados e incluso más lenta en medio básico . Es algo más estable a la oxidación anódica que el anión tetrafluoroborato BF 4- y el anión perclorato ClO 4- . La solubilidad de los hexafluorofosfatos sigue a la de los percloratos. Por ejemplo, hexafluorofosfato de potasio KPF 6y hexafluorofosfato de tetrametilamonio NMe 4 PF 6son poco solubles en agua mientras que el hexafluorofosfato de sodio NaPF 6, hexafluorofosfato de amonio NH 4 PF 6y los hexafluorofosfatos de metales alcalinotérreos son muy solubles en agua.
Pueden prepararse hexafluorofosfatos de metales alcalinos tales como sodio y potasio, así como hexafluorofosfato de amonio, haciendo reaccionar los correspondientes cloruros o fluoruros con ácido fluorhídrico HF y pentacloruro de fósforo PCl 5. :
M Cl + 6 HF + PCl 5⟶ MPF 6+ 6 HCl .La reacción de fluoruros , por ejemplo, fluoruro de potasio KF y fluoruro de cesio CsF, con trifluoruro de fósforo (en) PF 3, también da el correspondiente hexafluorofosfato:
3 M F + 5 PF 3 ( pulg ) ⟶ 3 MPF 6+ 2 P .También es posible hacer reaccionar hexaclorofosfaceno (NPCl 2 ) 3con fluoruro de hidrógeno HF para obtener hexafluorofosfato de amonio NH 4 PF 6 :
(NPCl 2 ) 3+ 18 HF ⟶ 2 NH 4 PF 6+ 6 HCl .Hexafluorofosfatos de nitrosonio NOPF 6y nitronio NO 2 PF 6se puede preparar haciendo reaccionar fósforo pentabromuro PBr 5y trifluoruro de bromo BrF 3con cloruro de nitrosilo NOCl y dióxido de nitrógeno NO 2 respectivamente.
La reacción del hexafluorofosfato de plata AgPF 6con haluros también pueden producir hexafluorofosfatos. Los haluros de plata forman precipitados que permiten que continúe la reacción. Dado que las sales de hexafluorofosfato a menudo son insolubles en agua pero solubles en disolventes orgánicos polares , la adición de hexafluorofosfato de amonio a soluciones acuosas de muchas sales inorgánicas da precipitados sólidos de sales de hexafluorofosfato. Este es, por ejemplo, el caso de la síntesis de sales de rodocenio :
RhCl 3 ⋅xH 2 O+ 2 C 5 H 6+ NH 4 PF 6⟶ [(η 5 −C 5 H 5 ) 2 Rh] PF 6 ↓+ 2 HCl + NH 4 Cl+ x H 2 O.Artículos relacionados
Notas y referencias
- masa molecular calculada de " pesos atómicos de los elementos 2007 " en www.chem.qmul.ac.uk .
- (en) Paul J. Dyson, Tilmann J. Geldbach, Reacciones catalizadas por metales en líquidos iónicos , Springer Science & Business Media, 2006, p. 27 . ( ISBN 978-1-4020-3915-7 )
- (en) Allen E. Gebala y Mark Jones , " La hidrólisis catalizada por ácido del hexafluorofosfato " , Journal of Inorganic and Nuclear Chemistry , vol. 31, n o 3, Marzo de 1969, p. 771-776 ( DOI 10.1016 / 0022-1902 (69) 80024-2 , leer en línea )
- (en) In Sung Chun, Sung Jin Moon, Young Mee Na Young-A. Lee, Kyung Ho Yoo y Ok-Sang Jung , “ Reconocimiento selectivo y sensible de hexafluorofosfato a través de un equilibrio inusual entre un huésped cuadrado catiónico y un PF 6 - invitado ”, Comunicaciones de Química Inorgánica ,vol. 10,n o 9,septiembre 2007, p. 967-970 ( DOI 10.1016 / j.inoche.2007.05.008 , leer en línea )
- (en) Ole Hammerich y Bernd Speiser, Orgánica Electroquímica , 5 ª Edición, CRC Press, 2015, p. 326 . ( ISBN 978-1-4200-8402-3 )
- (en) Arthur DF Toy, La química del fósforo , Textos de Pérgamo en química inorgánica, Elsevier, 1973, p. 537 . ( ISBN 978-1-4831-4741-3 )
- (en) JH Simons, Fluorine Chemistry , Elsevier, 2012, p. 56 . ( ISBN 0-323-14724-0 )
- (en) David R. Baghurst, D. Michael P. Mingo y Michael J. Watson , " Aplicación de los efectos de calentamiento por pérdida dieléctrica de microondas para la síntesis rápida y conveniente de compuestos organometálicos " , Journal of Organometallic Chemistry , vol. 368, n o 3, 13 de junio de 1989, C43-C45 ( DOI 10.1016 / 0022-328X (89) 85418-X , leer en línea )