La reacción de Wohl-Ziegler
El Wohl-Ziegler o Wohl-Ziegler bromante , llamado así por los químicos alemanes Alfred Wohl y Karl Ziegler , es una sustitución de radicales de reacción que conduce a la bromación de hidrocarburo alílico o bencílico usando una N -bromoimida con iniciador de radicales (convencionalmente AIBN o peróxido de benzoilo ) o por irradiación .
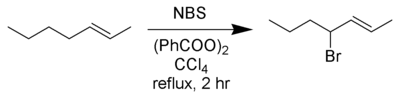
Los mejores rendimientos de esta reacción se obtuvieron utilizando N -bromosuccinimida (NBS) en solución en CCl 4anhidro. Los radicales alílico y bencilo formados durante la reacción son más estables que los otros radicales de carbono y los productos predominantes son bromuros alílicos y bencílicos.
Implementación
Una implementación típica de esta reacción es la adición de una cantidad estequiométrica de N- bromosuccinimida y una pequeña cantidad de iniciador a una solución del sustrato en CCl 4., luego la mezcla se agita y se lleva a ebullición. El inicio de la reacción se indica mediante una ebullición más vigorosa, que a veces obliga a detener el calentamiento. Una vez que toda la N- bromosuccinimida (más densa que el disolvente) se ha convertido en succinimida (que flota en el disolvente), la reacción finaliza.
El medio debe permanecer estrictamente anhidro durante toda la reacción, siendo fácilmente hidrolizable el producto deseado . El carbonato de bario se usa a menudo para mantener estas condiciones anhidras y no ácidas.
Mecanismo de reacción
El mecanismo que se presenta aquí es el de la bromación de ciclohexeno .
Iniciación:
- Descomposición de AIBN en dinitrógeno y radical cianuro

- Reacción del radical con NBS y formación del radical bromo
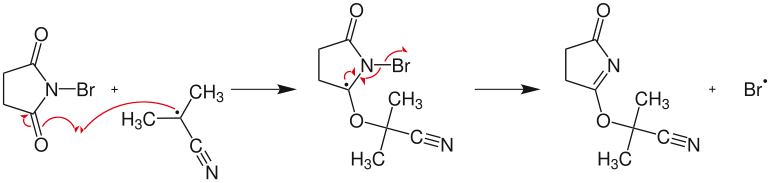
Propagación en cadena:
- Reacción radical entre el radical bromo y el ciclohexeno formando bromuro de hidrógeno y un radical ciclohexenilo:

- Reacción entre NBS que forma succinimida y dibroma

- Adición radical de bromo al ciclohexenilo para formar el producto final ( bromociclohexeno ) con regeneración del radical bromo permitiendo que el mecanismo de la cadena se inicie nuevamente:

Regioselectividad
La reacción de Wohl-Ziegler broma preferentemente la posición más concurrida si el sustrato tiene varias posiciones alílicas. Esta regioselectividad corresponde a la formación del radical más estabilizado.
Cuando la molécula tiene un anillo aromático , la reacción de Wohl-Ziegler forma exclusivamente el producto de bromación de la posición bencilo , sin ninguna bromación del anillo.
Notas y referencias
- (De) A. Wohl , " Bromierung ungesättigter Verbindungen mit N-Brom-acetamid, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge " , Ber. Dtsch. Chem. Ges. , vol. 52, n o 1,1919, p. 51-63 ( ISSN 0009-2940 , DOI 10.1002 / cber.19190520109 ).
- (De) K. Ziegler , " Die Synthese des Cantharidins " , Liebigs Ann. Chem. , vol. 551, n o 1,1942, p. 1–79 ( ISSN 0075-4617 , DOI 10.1002 / jlac.19425510102 ).
- (en) FL Greenwood y MD Kellert , " 4-bromo-2-hepteno " , Org. Synth. , vol. 58,1958, p. 8 ( ISSN 0078-6209 , DOI 10.15227 / orgsyn.038.0008 ).
- (en) C. Djerassi , " Brominaciones con N-bromosuccinimida y compuestos relacionados. La reacción de Wohl-Ziegler ” , Chem. Rvdo. , vol. 43, n o 21948, p. 271–317 ( ISSN 0009-2665 , DOI 10.1021 / cr60135a004 ).
- (De) L. Horner y EM Winkelman , " Neuere Methoden der präparativen organischen Chemie II 14. N-Bromsuccinimid, Eigenschaften und Reaktionsweisen Studien zum Ablauf der Substitution XV " , Angew. Chem. , vol. 71, n o 11,1959, p. 349–365 ( ISSN 1433-7851 , DOI 10.1002 / ange.19590711102 ).
- (in) RW Binkley y GS Goewey , " apertura de anillo regioselectiva de acetales de bencilideno seleccionados. Una reacción iniciada fotoquímicamente para la desprotección parcial de carbohidratos ” , J. Org. Chem. , vol. 49, n o 6,1984, p. 992–996 ( ISSN 0022-3263 , DOI 10.1021 / jo00180a008 ).
- Kürti y Czakó 2005 , p. 492
- (en) / (de) Este artículo es parcial o totalmente extraído de los artículos titulados en inglés " Wohl-Ziegler bromination " ( ver la lista de autores ) y en alemán " Wohl-Ziegler-Reaktion " ( ver la lista de autores ) .
Bibliografía
- (en) László Kürti y Barbara Czakó , Aplicaciones estratégicas de reacciones nombradas en síntesis orgánica: antecedentes y mecanismos detallados , Amsterdam, Elsevier Academic press,2005, 758 p. ( ISBN 0-12-429785-4 )