Parálisis supranuclear progresiva
Parálisis supranuclear progresiva - PSP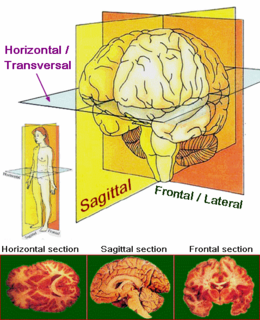 Principales planos y ejes anatómicos aplicados a secciones del cerebro.
Principales planos y ejes anatómicos aplicados a secciones del cerebro.
| Especialidad | Neurología |
|---|
| ICD - 10 | G23.1 |
|---|---|
| CIM - 9 | 333,0 |
| OMIM | 601104 |
| Enfermedades DB | 10723 |
| MedlinePlus | 000767 |
| eMedicina | 1151430 |
| eMedicina | neuro / 328 |
| Malla | D013494 |
| Paciente del Reino Unido | Progresiva-parálisis-supranuclear-pro |
La parálisis supranuclear progresiva (PSP o enfermedad de Steele-Richardson-Olszewski , los nombres de los médicos que la caracterizaron en 1963) es una enfermedad neurodegenerativa debida a la destrucción progresiva de neuronas de diversas regiones del cerebro, el estriado , la formación entrecruzada del tronco encefálico. , el locus de Níger , los núcleos de los nervios craneales . Estas lesiones en particular provocan dificultad en la realización de movimientos sacádicos verticales del ojo ( oftalmoplejía supranuclear ), característica de la PSP, pero también afectan gradualmente el equilibrio , la vista , la marcha , la deglución , el habla y, de forma más general, los movimientos realizados en el plano sagital . La PSP afecta a alrededor de seis de cada 100.000 personas, tanto hombres como mujeres, sin poder identificar ningún factor de riesgo ligado a la etnia, entorno de vida o actividad profesional. Algunos de los síntomas de la PSP son similares a los de la degeneración frontotemporal , la enfermedad de Parkinson o la atrofia multisistémica, pero se distingue por el daño oculomotor. Los mecanismos patológicos de la PSP siguen siendo poco conocidos: a veces se describe como tauopatía porque la degeneración neurofibrilar se asocia con una acumulación de proteína Tau en las células nerviosas.
Descubrimiento
Esta condición fue descrita por primera vez en 1904, aunque las búsquedas de la técnica anterior evocan casos de PSP probable al menos desde la mitad de la XIX XX siglo. Sin embargo, esto es lo que, siguiendo las observaciones de P r J. Clifford Richardson en 1950 en Toronto, y después de haber invitado a P r John Steele y P r Jerzy Olszewski (pl) a estudiar los cambios patológicos en el sistema nervioso central, PSP ser identificado como una enfermedad por derecho propio porJunio de 1963. Con la publicación en 1964 del trabajo de los tres neurólogos, la PSP será reconocida con su nombre actual, como una entidad nosológica específica, también conocida con el nombre de "Enfermedad de Richardson-Olszewski", "Síndrome de Steele" en Estados Unidos. y bajo el nombre de “enfermedad de Steele-Richardson-Olszewski” en Europa.
El síndrome de Guam, también identificado por el P r John Steele, es una forma particular de PSP de la isla de Guam , en el Pacífico. Por lo tanto, también es un síndrome parkinsoniano atípico que a menudo es la asociación de la enfermedad de Parkinson con la esclerosis lateral amiotrófica y la demencia.
Explicación del término
Por lo general, una "parálisis" es una debilidad motora o parálisis de una parte del cuerpo.
El término "supranuclear" se refiere a la naturaleza del problema ocular en la PSP. Aunque algunos pacientes con PSP describen su síntoma como "borroso", el problema real es la incapacidad de apuntar correctamente a los ojos debido a la debilidad (o parálisis) de los músculos que mueven los globos oculares. Estos músculos están controlados por células nerviosas que residen en grupos, o "núcleos", cerca de la base del cerebro, en el tronco del encéfalo.
La mayoría de los problemas que afectan los movimientos oculares se originan en estos núcleos del cerebro, pero en la PSP el problema se origina en partes del cerebro que controlan estos núcleos. Estas zonas de control "superiores" son a las que se refiere el prefijo " supra " en "supranuclear" (por encima de los núcleos) .
Fisiopatología
Las principales áreas del cerebro afectadas por la PSP son:
- el tronco encefálico , en particular la parte del mesencéfalo donde reside el movimiento "supranuclear" del ojo, así como los núcleos dopaminérgicos;
- los ganglios basales , en particular el núcleo subtalámico , la sustancia negra (o locus niger ) y el globo pálido ;
- la corteza cerebral , especialmente el área de los lóbulos frontales;
- el núcleo serrado del cerebelo (el cerebelo representa un buen 50% de nuestras neuronas) ;
- y la médula espinal , especialmente el área donde se realizan ciertos controles de la vejiga y los intestinos.
Epidemiología
La PSP es una enfermedad rara porque afecta a menos de una de cada 2.000 personas, un umbral por debajo del cual, en la Unión Europea, una enfermedad se define como rara. La prevalencia más notificada de PSP es de alrededor de 6 pacientes por cada 100.000 personas. Esta cifra sigue siendo solo una indicación hasta el día de hoy. También es una enfermedad huérfana en la medida en que actualmente no se conoce un tratamiento eficaz. La PSP es una enfermedad de pronóstico severo.
Afecta a decenas de miles de personas en Estados Unidos y Europa (40.000 a 60.000, según estimaciones). Afecta un poco más a los hombres que a las mujeres (diferencia de alrededor del 2%). Ocurre principalmente en personas de entre 55 y 65 años.
Diagnóstico
Síntomas
Los primeros síntomas son ralentización intelectual con retención de memoria episódica , cambios de comportamiento como pérdida de interés ( apatía ) o irritabilidad. Estos trastornos del comportamiento pueden imitar un estado depresivo. Los pacientes consultan con mayor frecuencia por trastornos graves del equilibrio, responsables de las caídas. Estos pacientes pueden caerse varias veces al día; cae hacia atrás, a mitad de camino. Los pacientes son muy inestables y tienden a caer en la silla. La pérdida de equilibrio se agrava hasta el punto de dificultar o incluso imposibilitar la marcha.
Los trastornos de la fluidez verbal y del habla son variados: tartamudeo ( palilalia , ecolalia ), perseverancia verbal, ruido nasal y dificultad para emitir frases comprensibles.
Trastorno de atención: El paciente tiene dificultad para mantener una conversación prolongada, cambiando bruscamente de tema sin darse cuenta al cabo de unos minutos. Este período se acorta para hacer imposible la conversación, con una evolución concomitante hacia la afasia .
Además de los trastornos del equilibrio y la movilidad, se agregan trastornos más insidiosos como las dificultades visuales. Estos problemas visuales son el resultado de la incapacidad de guiar los ojos debido al daño en los centros del cerebro que controlan los movimientos oculares. Los trastornos de la deglución se producen más tarde y pueden dar lugar a “rutas falsas” de alimentos, que a su vez provocan complicaciones pulmonares: la asfixia por asfixia es una causa frecuente de muerte al final del curso. Para mantener una dieta correcta para el paciente, sin tomar el camino equivocado, la gastrostomía puede volverse imprescindible, al igual que el uso de un aspirador traqueal para flemas.
Dado que el orden de aparición de los síntomas varía de una persona a otra y los síntomas en sí mismos son comunes a otras patologías, el diagnóstico sigue siendo difícil. El diagnóstico puede sospecharse clínicamente ante trastornos posturales, signos parkinsonianos axiales y trastornos oculomotores. El examen clínico buscará lentitud en la mirada hacia arriba, rigidez cervical, más generalmente un déficit motor en el plano sagital, trastornos cognitivos frontales subcorticales y dificultad para detener movimientos motores repetidos como secuencia de 3 aplausos.
El déficit motor en el plano sagital explica las dificultades oculares verticales, el espontáneo se queda atrás al detenerse por defecto de corrección postural, la dificultad para tragar. La deficiencia oculomotora también induce caídas hacia adelante, ya que el paciente ya no puede controlar subrepticiamente la presencia de obstáculos en el suelo a su paso (adaptación del entorno del paciente).
Entre los principales síntomas y signos clínicos, debemos recordar:
- alteraciones del equilibrio que van hasta las caídas (signo temprano) y más particularmente hacia atrás,
- la magnetización de la mirada: pérdida de movilidad de la mirada y particularmente en el movimiento de los ojos de arriba a abajo,
- cambios en el comportamiento: lentitud al caminar, fluidez en las palabras, apatía, impulsividad, agresividad, inestabilidad de atención y habla monótona,
- Comportamiento de agarre: dificultad para soltar la mano de los objetos sostenidos,
- la presencia de un síndrome disejecutivo: perseverancia, alteración del juicio, dificultades para resolver problemas.
Exámenes adicionales
La MRI cerebro puede revelar algunas anormalidades características: adelgazamiento de la parte superior de la protuberancia (sagital), el espaciamiento de los pedúnculos cerebrales (sección axial), ampliación de la 4 º ventrículo (sección axial), atrofia frontal.
En general, es el examen neuropatológico el que hace el diagnóstico de PSP, en función de la distribución topográfica de las lesiones, cuya interpretación puede ser común a otras taupatías como DCB y determinadas DFT de tipo lóbulo.
Hasta la fecha, se han establecido cinco variantes del PSP:
- PSP clásica (la más frecuente) y otras cuatro atípicas:
- PSP de tipo parkinsoniano (PSP-P);
- PSP-acinesia pura con "congelación" de la marcha (PSP-PAGF);
- Síndrome PSP-corticobasal (PSP-CBS);
- PSP-afasia progresiva no fluida (PSP-PNFA).
Diagnóstico diferencial
Los principales diagnósticos diferenciales son:
- la enfermedad de Alzheimer (EA);
- la enfermedad de Parkinson (EP);
- la degeneración corticobasal (DCB);
- la degeneración frontotemporal (DFT) o enfermedad de Pick ;
- el sistema múltiple de atrofia (AMS).
La PSP puede ser difícil de reconocer al menos al inicio de la enfermedad porque los trastornos iniciales también están presentes en otras enfermedades neurodegenerativas , como las más conocidas las de Parkinson y Alzheimer , pero también como las de AMS ( Atrophy Multi-Systematized ), o DCB ( Degeneración Cortico-Basal ) que está muy cerca de PSP. No hace mucho, en el caso de DCB, los médicos experimentados se equivocaban más del 50% de las veces.
El error de diagnóstico sigue siendo importante, en promedio más de tres años, con fuertes disparidades. Se considera que la PSP representa al menos el 5% de los síndromes parkinsonianos, por lo que tiene importancia, el segundo síndrome parkinsoniano después de la enfermedad de Parkinson.
La oftalmoplejía Supranuclear ("magnetización de la mirada" la estabilidad y la reducción del campo especialmente vertical) que logran los pacientes, sigue siendo una de las primeras características visibles para el diagnóstico. De hecho, la consecuencia de la parálisis de los globos oculares es provocar caídas hacia atrás inexplicables. Por otro lado, no hay temblor parkinsoniano y los síntomas son resistentes al tratamiento con L-Dopa .
La PSP es uno de los síndromes parkinsonianos cuyo proceso evolutivo se conoce pero no la causa exacta. Se distingue de la enfermedad de Parkinson por un curso más severo, con poca o ninguna respuesta al tratamiento. La PSP, como la DCB, que es muy similar a ella, son enfermedades de mal pronóstico, de progresión gradual, muy debilitantes y para las que hasta la fecha solo se pueden tratar los síntomas. De cuidados paliativos es de esperar.
En los síndromes parkinsonianos degenerativos atípicos a veces denominados síndromes parkinsonianos plus , que se diferencian de la enfermedad de Parkinson en particular por la baja o incluso la ausencia de reactividad al tratamiento dopaminérgico resultante, entre otras cosas, de lesiones postsinápticas, distinguimos por tanto:
- atrofia multisistémica y demencia con cuerpos de Lewy en sinucleinopatías ;
- parálisis supranuclear progresiva y degeneración corticobasal en tauopatías.
Genética y factores de riesgo
La PSP no es hereditaria . De hecho, cuando un miembro de la familia tiene PSP, hay menos del 1% de los casos en los que otros miembros de la misma familia muestran síntomas de PSP. En comparación, para una enfermedad que también se considera no hereditaria: el 15% de las personas con Parkinson tienen un pariente afectado, y al menos el 5% de los pacientes se reconoce que tiene una forma de Parkinson relacionada con una mutación en genes específicos.
Una variante del gen de la proteína tau llamada haplotipo H1, que se encuentra en el cromosoma 17, se ha relacionado con la PSP . Casi todas las personas con PSP han recibido esta variante de cada uno de sus padres, pero también lo hacen alrededor de dos tercios de la población general. Por tanto, el haplotipo H1 parece ser necesario, pero no suficiente, para generar PSP.
Se están llevando a cabo investigaciones sobre otros genes (posibles predisposiciones genéticas ) , así como sobre componentes ambientales tóxicos, así como sobre otros contribuyentes sospechosos de intervenir en la aparición de la enfermedad.
Para el síndrome de Guam y los síndromes parkinsonianos atípicos de las Antillas, incluida Guadalupe, se ha demostrado, para estos PSP, un riesgo adicional de aparición por un factor alimentario (consumo en particular de guanábana ). Además, se observó una epidemia de PSP en Wattrelos, correlacionada con una contaminación significativa con arsénico . Los dos tienen en común que son potentes inhibidores mitocondriales. Por tanto, además de la tauopatía, la disfunción mitocondrial parece ser un factor importante en esta enfermedad.
Tratamiento
Para determinados perfiles de PSP, y al inicio de la enfermedad, se pueden utilizar tratamientos adaptados a la enfermedad de Parkinson ( dopamina , rivastigmina , etc. ). Sin embargo, en caso de resultados, estos suelen ser débiles y siempre temporales. Por otro lado, conviene recordar que, para el paciente, se toma cualquier ganancia obtenida.
Los tratamientos actuales, a lo largo del tiempo, son por tanto esencialmente sintomáticos y buscan combatir las molestias provocadas por la enfermedad y su progresión. Como tal, la familia y el entorno del paciente son fundamentales, pero ellos mismos deben ser apoyados y ayudados a nivel material y moral para la implementación de cuidados paliativos y tratamientos acordes a la evolución de la enfermedad. La silla de ruedas y los arreglos asociados son equipos bastante tempranos en PSP.
El Parlamento Europeo ya ha adoptado un reglamento sobre medicamentos huérfanos desde 15 de diciembre de 1999.
Finalmente, tras obtener el estatus de “fármaco huérfano” de la FDA y EMEA ( las dos agencias farmacéuticas de Estados Unidos y Europa ) , se encuentran en proceso de liberación dos fármacos, Davunetide y ZentylorTM . Ensayo de fase II para controlar la PSP. Obtuvieron la aprobación de la FDA para un procedimiento de evaluación acelerado bajo las nuevas disposiciones de biotecnología .
Desde principios de 2013, lamentablemente hemos sabido, para Davunetide en un ensayo de fase III, que ninguno de los criterios de valoración secundarios o exploratorios mostró signos de cambio. Es de esperar que, a pesar de todo, este fracaso contribuya positivamente a la lucha contra esta enfermedad.
Pronóstico
La enfermedad no es directamente fatal, por otro lado acorta la esperanza de vida de quienes la padecen. Dado el error diagnóstico por un lado y la edad del paciente y el estado general de salud por otro lado, esta esperanza de vida para un paciente diagnosticado de PSP rara vez supera los 15 años. Por otro lado, los promedios en esta área no son significativos porque no reflejan las fuertes disparidades de un paciente a otro. La media más aceptada ronda los 7 años. Las principales causas de reducción de la esperanza de vida, o incluso de la mortalidad, en pacientes con PSP pueden ser:
- caídas accidentales hacia atrás, característica de la enfermedad;
- infecciones del tracto respiratorio por aspiración repetida;
- Agotamiento general y prematuro del paciente, especialmente si el paciente padece otras patologías y es anciano.
Investigar
Diagnóstico
Examen neuropatológico post-mortem / AnatomopatologíaAl igual que con otras enfermedades neurodegenerativas, sigue siendo, hasta el día de hoy, el único examen que permite un diagnóstico definitivo de parálisis supranuclear progresiva. En este sentido, los pacientes y sus familias que donan sus cerebros permiten avanzar considerablemente en el conocimiento y la lucha contra la PSP y las enfermedades neurodegenerativas.
Aunque se estableció que también hubo daño al sistema nervioso entérico en los pacientes de Parkinson, parece haber una correlación entre el daño al sistema nervioso central y el daño al sistema nervioso entérico. Este avance es considerable para el cribado y para el desarrollo y "puesta a punto" de fármacos actuales y futuros. De hecho, el sistema nervioso central es accesible solo después de la muerte de los pacientes. Este no es el caso de sistemas nerviosos periféricos como el sistema nervioso entérico, que tiene la ventaja de poder realizar investigaciones in vivo mediante una simple biopsia . De este modo se evitaría la dificultad del diagnóstico.
Otros enfoquesEl proyecto europeo NNIPPS, en el que participaron 800 pacientes, propuso en 2001 estudiar las especificidades clínicas, cognitivas, neurorradiológicas e histológicas de la PSP. Desafortunadamente, los resultados finales publicados en 2011 confirmaron que los ensayos no habían arrojado los resultados de eficacia esperados. También se están realizando investigaciones sobre la naturaleza de los trastornos oculomotores y del equilibrio que son característicos de la afección.
Las enfermedades DCB, PSP, DFT, incluida la enfermedad de Pick, se consideran taupatías (o tauopatías), enfermedades debidas a anomalías de la proteína tau , al igual que la enfermedad de Alzheimer, más conocida por el número de pacientes afectados.
Sin embargo, la clasificación de las patologías neurodegenerativas se ha vuelto más complicada desde mediados hasta finales de la década de 1990.
Con enfoques moleculares y genéticos, para las enfermedades neurodegenerativas ha aparecido una nueva clasificación y definición, basada en la naturaleza de los constituyentes de las lesiones neuropatológicas:
- Las tauopatías incluyen enfermedades en las que intervienen los microtúbulos de proteína tau. Se forman grumos o arbustos de proteína tau, se acumulan y se extienden, lo que conduce gradualmente a la muerte neuronal de las células contaminadas. Las principales taupatías degenerativas en adultos son la enfermedad de Alzheimer, la parálisis supranuclear progresiva, la degeneración cortico-basal, y que también se comparan con la enfermedad de los granos argirofílicos , la enfermedad de Pick y las degeneraciones frontotemporales con síndrome parkinsoniano vinculadas al cromosoma 17.
- Las sinucleinopatías tienen depósitos anormales de alfa-sinucleína . Esta proteína presináptica es un componente importante de las lesiones de la enfermedad de Parkinson y de las demencias con cuerpos de Lewy, así como de múltiples atrofias sistémicas. En las inclusiones citoplásmicas gliales de atrofia múltiple sistematizada, también se observa una acumulación de proteínas alfa-sinucleína.
La proteína FKBP52 actúa como una especie de proteína anti-Tau en el sentido de que una alta presencia de FKBP52 evitaría la acumulación de proteínas Tau en las neuronas. Como tal, la proteína FKBP52 está en estudio, con un doble desafío: permitir un mejor cribado midiendo la cantidad de proteína FKBP52 y desarrollar fármacos para bloquear el desarrollo de la patología tau.
Todos estos experimentos se continuarán con el fin de obtener resultados más amplios capaces de modelar procesos terapéuticos, en particular basados en estrategias dirigidas a la proteína Tau.
En investigación aplicada, se están realizando ensayos sobre diferentes moléculas ya conocidas pero dosificadas para poder constituir un tratamiento contra la PSP. Este es el caso del litio (Estados Unidos), Q10 (Estados Unidos y Reino Unido), valproato de sodio (Francia), cloruro de metiltioninio , etc. Hasta la fecha, incluso para las moléculas más prometedoras en las primeras etapas de prueba, estos fármacos no han proporcionado los efectos terapéuticos esperados.
También conviene mencionar las pruebas sobre la proteína esfingomielinasa neutra (N-SMasa) que, desencadenada por lesiones amiloides y DNF (en las que interviene tau) , quedaría inoperante en el proceso apoptótico de muerte neuronal, una vez que esta proteína N-SMasa inhibido. El resultado esperado sería igual al capital neuronal así conservado, en particular en términos de memoria en el caso de la enfermedad de Alzheimer.
Mecanismos
La proteína tau, una proteína fuertemente involucradaLa codificación de proteínas obedece a complejos mecanismos bioquímicos y moleculares, deliberadamente para asumir funciones normales de vida o muerte ( apoptosis ) de nuestras células.
En la década de 1980, la degeneración neurofibrilar se asoció con la proteína tau que, durante mucho tiempo descuidada por la investigación, ahora despierta un renovado interés.
La proteína tau, como todas las demás proteínas, está codificada por nuestros genes y el gen que codifica la proteína tau se encuentra en el cromosoma 17 . Todo ser humano produce la proteína tau que normalmente no es patógena y que, incluso cuando puede llegar a serlo con la edad, sigue siendo no tóxica porque no se expande en el sistema nervioso. Los mecanismos que gobiernan la transición de la situación no patógena de proteína tau a patógeno, luego de patógeno a tóxico, permanecen sin explicación.
El curso de la enfermedad corresponde al de tau en el cerebro. La patología tau tiene una firma bioquímica y morfológica de degeneración neurofibrilar. Por otro lado, no se puede esperar una relación muy precisa entre una región afectada y un signo cognitivo específico, porque intervienen otros factores agravantes.
Sin embargo, debe recordarse que la patología tau tiene un significado, en la medida en que la patología va en dirección a los signos clínicos. Por ejemplo, para la enfermedad de Alzheimer: pérdida de memoria ( hipocampo afectado) luego afasia gradualmente ( corteza temporal media y superior afectada como en la demencia semántica , luego frontal anterior y área de Broca que son áreas diferentes del lenguaje), apraxia ( corteza frontal afectada) agnosia ( lóbulo parietal , lóbulo occipital ). La afectación frontal también puede provocar alteraciones del comportamiento.
Cuanto más avanza la patología tau en la corteza, más variable se vuelve la ruta, dependiendo de la vulnerabilidad individual. La variación en la participación de regiones de la corteza asociativa y luego primaria causa variaciones clínicas marcadas entre individuos. Es por ello que cada enfermedad neurodegenerativa tiene un perfil general y estadístico bastante preciso y constante, pero cada caso tiene su especificidad. Este perfil de desarrollo se puede representar, por ejemplo, para la enfermedad de Alzheimer, en 10 etapas características de los ataques.
Organización de tratamientos, cuidados e investigación en Francia
Desde Mayo de 2007, en el marco del primer Plan Nacional de Enfermedades Raras, junto con la asociación PSP France, se ha habilitado un centro de referencia para la parálisis supranuclear progresiva en el hospital Salpétrière de París.
Desde Marzo de 2009, la red nacional de centros de referencia y competencia para PSP tiene como objetivo proporcionar experiencia adicional en apoyo, tratamiento e investigación. La asociación PSP France (para PSP y DCB), unida a principios de 2010 por la asociación France-DFT (para DFT), son hasta la fecha las dos únicas asociaciones de pacientes presentes dentro de esta red para demencias raras, en el significado médico del término y no psiquiátrico (clasificación nosológica) .
Desde el 28 de febrero de 2011, se ha renovado el PNMR (Plan Nacional de Enfermedades Raras) y cuenta con un presupuesto de 180 millones de euros.
La investigación, incluido el centro NeuroSpin , tiene como objetivo comprender mejor los mecanismos de la degeneración neuronal, para reconocerlos y prevenirlos mejor; para frenar mejor la progresión de este tipo de enfermedad, o incluso curarla.
Personalidades con la enfermedad
- Peter Sarstedt (1941-2017), cantante inglés.
- Abdus Salam (1926-1996), físico paquistaní ganador del Premio Nobel de Física en 1979 con Sheldon Glashow y Steven Weinberg .
Notas y referencias
- Charles Dickens (1857), literatura y PSP
- (en) Richardson JC Steele J, Olszewski J, " Oftalmoplejía supranuclear, parálisis pseudobulbar, distonía nucal y demencia. Un informe clínico sobre ocho casos de 'degeneración del sistema heterogéneo' ” , Transactions of the American Neurological Association , vol. 88, 1963, p. 25–9 ( PMID 14272249 )
- (en) I. Litvan et al. “Precisión del diagnóstico clínico de la degeneración corticobasal: un estudio clínico-patológico” Neurology 1997: 48: 119-25.
- (en) Samii A Nutt JG, BR Ransom, " Enfermedad de Parkinson " , Lancet , vol. 363, n o 9423,Mayo de 2004, p. 1783–93 ( PMID 15172778 , DOI 10.1016 / S0140-6736 (04) 16305-8 )
- (in) Lesage S Brice A, " Enfermedad de Parkinson: de formas monogénicas a factores de susceptibilidad genética " , Hum. Mol. Escoba. , vol. 18, n o R1,abril de 2009, R48–59 ( PMID 19297401 , DOI 10.1093 / hmg / ddp012 )
- [PDF] Medicamento huérfano
- El estudio multinacional de Davunetide , que involucra a 300 pacientes, se está llevando a cabo en las principales instituciones médicas de Estados Unidos, Australia, Alemania, Francia, Canadá y Reino Unido. [1]
- [PDF] Procedimiento acelerado
- [PDF] Archivo de biotecnología
- Sitio explicativo de la donación de cerebros
- [PDF] PLoS ONE, septiembre de 2010 | Volumen 5 | Número 9 | e12728
- [PDF] PLoS ONE, agosto de 2011 | Volumen 6 | Número 8 | e22293
- [PDF] cpINSERM 26 de enero de 2010
- [PDF] Estrategia dirigida a la proteína Tau , Manejo de la enfermedad de Alzheimer: datos actuales y en desarrollo - Extractos de marzo de 2011
- [PDF] Nuevo objetivo contra el Alzheimer
- Annals of the Institut Pasteur / News - Volumen 11, Número 2, 6 de abril de 2000, Páginas 25-45.
- (en) Delacourte A David JP, Sergeant N et al. “La vía bioquímica de la degeneración neurofibrilar en el envejecimiento y la enfermedad de Alzheimer” Neurology 1999; 52: 1158-65.
- (in) A Delacourte A y L Condensación "Proteínas Tau normales y patológicas como factores para el ensamblaje de microtúbulos" Int Rev Cytol. 1997; 171: 167-224.
- [PDF] Plan Nacional de Enfermedades Raras 2005-2008
- Red nacional de centros de referencia y competencia para PSP
- Plan Nacional de Enfermedades Raras 2010-2014
- [PDF] Neurospin 24 de noviembre de 2006
- "El cantautor Peter Sarstaedt muere a los 75 años" , BBC , 8 de enero de 2017
Referencias externas
- El cerebro en todos los niveles : un blog canadiense para leer.
- Red de centros de referencia y competencia para las demencias raras
- ORPHANET, el portal de enfermedades raras y medicamentos huérfanos
- PSP 39 - Parkinson Síndromes de Parkinson
- Fundación PSP - Estados Unidos
- Asociación de Parálisis Supranuclear Progresiva - PSP France
Galería de imágenes
-
Mesencéfalo y rombencéfalo (vista posterolateral ).
-
Base del cerebro.
-
Desde el ojo hasta la corteza visual .
-
Diagrama de las vías ópticas entre las dos retinas y la corteza visual.