Ion de hidronio
| Ion de hidronio | |
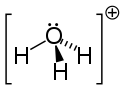   Estructura del ion hidronio. |
|
| Identificación | |
|---|---|
| Nombre IUPAC | oxonio |
| N o CAS | |
| PubChem | 123332 |
| CHEBI | 29412 |
| Sonrisas |
[OH3 +] , |
| InChI |
InChI: InChI = 1S / H2O / h1H2 / p + 1 InChIKey: XLYOFNOQVPJJNP-UHFFFAOYSA-O |
| Propiedades químicas | |
| Fórmula bruta | H 3 O + (ac) |
| Masa molar | 19.0232 ± 0.0005 g / mol H 15.9%, O 84.1%, |
| pKa | −1,74 a 25 ° C |
| Unidades de SI y STP a menos que se indique lo contrario. | |
El ion hidronio es el más simple de los iones oxonio ; su fórmula química es H 3 O +o H + (aq). En solución acuosa , se solvata con varias moléculas de agua y puede escribirse H 7 O 3 +, H 9 O 4 +etc. Es el resultado de la protonación de una molécula de agua, ya sea por un ácido o por autoprotólisis del agua. También existe en estado sólido y en estado gaseoso. También es un ion que se encuentra en el medio interestelar , donde resulta de la interacción de las moléculas de agua con la radiación cósmica .
Nomenclatura
La nomenclatura de la IUPAC para la química orgánica recomienda designar el ion H 3 O +por oxonio . El término hidroxonio también se puede utilizar para evitar dudas . Un proyecto de recomendación de la IUPAC también recomendaría el uso del término oxidanio en el contexto de la química inorgánica específicamente, pero este nombre es actualmente inusual en la práctica.
Geometría
Dado que el ión O + y el átomo de N tienen el mismo número de electrones , el ión H 3 O +es isoelectrónico con la molécula de amoniaco NH 3, de ahí su geometría piramidal trigonal con, en la parte superior, el átomo de oxígeno. El ángulo HOH es del orden de 113 °.
Solvacion
La solvatación del ion hidronio en agua aún no está completamente caracterizada. La geometría predominante deducida de la crioscopia del agua sería H 3 O + (H 2 O) 6 : cada ion está en promedio solvatado por seis moléculas de agua, que ya no pueden solvatar otro ion.
Otras estructuras de solvatación involucran más moléculas de agua, en particular H 3 O + (H 2 O) 20en el que el ion hidronio está en el centro de un dodecaedro de agua. Sin embargo, las simulaciones realizadas por el método ab initio de la química cuántica indicarían que el protón hidratado se ubicaría en promedio más bien en la superficie del agregado de H 3 O + (H 2 O) 20.
Un equipo de California propuso en 2010 un nuevo modelo basado en sus análisis de espectroscopía infrarroja según el cual los protones se solvatan en forma de agregados [H 13 O 6 ] +en el que la carga eléctrica positiva se distribuiría indiscriminadamente entre las seis moléculas de agua.
El monómero H 3 O +La fase líquida fue identificada en 1979 por resonancia magnética nuclear en oxígeno 17 en una solución superácido nucleofílico débilmente no acuoso HF-SbF 5 SO 2( fluoruro de hidrógeno , pentafluoruro de antimonio , dióxido de azufre ).
El ion oxonio está presente permanentemente en el agua, debido a la reacción de autoprotólisis :
- En primer lugar, está la disociación de una molécula de agua: H 2 O H + + HO -
- Luego, una segunda molécula de agua solvata el protón liberado: H 2 O+ H + H 3 O +
- Finalmente, el protón solvatado obtenido, llamado ión oxonio , se hidrata en solución y por lo tanto se denota H 3 O + (aq), abreviado como "acuoso" en referencia al hecho de que está en solución.
El esquema de reacción general se puede escribir:
2 H 2 O H 3 O + (ac) + HO - (ac)HO - (aq)siendo el ion hidróxido , también solvatado.
pH del agua pura a 25 ° C
La constante de equilibrio de la autoprotólisis del agua a 25 ° C es:
K eq = [H 3 O +] × [HO - ] / [H 2 O] 2 = 10-14 .Una constante de equilibrio se aplica no a las concentraciones, sino a las actividades. Actividad de agua H 2 O El solvente es el de un líquido prácticamente puro y es igual a 1 por convención.
La constante de ionización del agua a 25 ° C se escribe:
K e = K eq × [H 2 O] 2 = [H 3 O +] × [HO - ] = 10-14 ,Esto significa que :
[H 3 O +] = [HO - ] = 10 -7 ,de ahí el valor de pH del agua pura a 25 ° C :
pH = - log 10 ([H 3 O +]) = 7.El ion oxonio es responsable de la propiedad de los ácidos según la definición de Joannes Brønsted . Está presente en cualquier solución acuosa en equilibrio con el ion hidróxido HO - . Es la medida de su concentración lo que permite determinar el pH de la solución.
Referencias
- [1]
- masa molecular calculada de " pesos atómicos de los elementos 2007 " en www.chem.qmul.ac.uk .
-
(en) Jian Tang y Takeshi Oka , " Espectroscopia infrarroja de H 3 O +
: The ν 1 Fundamental Band ” , Journal of Molecular Spectroscopy , vol. 196, n o 1,Julio de 1999, p. 120-130 ( leer en línea )
DOI : 10.1006 / jmsp.1999.7844 -
DOI : 10.1021 / ja9101826 -
(en) Gheorghe D. Mateescu, George M. Benedikt , " Agua y sistemas relacionados. 1. El ion hidronio (H 3 O +
). Preparación y caracterización por resonancia magnética nuclear de oxígeno-17 de alta resolución ” , Revista de la Sociedad Química Estadounidense , vol. 101, n o 14,1979, p. 3959-3960 ( leer en línea )
DOI : 10.1021 / ja00508a040
