Etano
| Etano | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
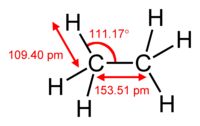
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molécula de etano | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificación | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nombre IUPAC | etano | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sinónimos |
dimetil |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100.000.741 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CE | 200-814-8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 6324 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sonrisas |
CC , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1S / C2H6 / c1-2 / h1-2H3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | gas comprimido licuado, incoloro, inodoro en estado puro. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades químicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fórmula bruta |
C 2 H 6 [Isómeros] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa molar | 30,069 ± 0,002 g / mol C 79,89%, H 20,11%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fusión | −183,3 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° hirviendo | −88,6 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilidad |
60,2 mg · l -1 ( agua , 25 ° C ) 460 ml · l -1 ( etanol , 4 ° C ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parámetro de solubilidad δ | 12,3 MPa 1/2 ( 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad |
1.3551 kg · m -3 ( 0 ° C , 1 013 mbar , gas) 0.5441 kg · l -1 ( -88,6 ° C , 1 013 mbar , líquido) ecuación:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura de autoignición | 515 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| punto de inflamabilidad | −135 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Límites explosivos en el aire |
2,4 - 14,3 % por volumen 31 - 182 g · m -3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor saturante |
37,8 bar a 20 ° C 46,9 bar a 30 ° C ecuación:
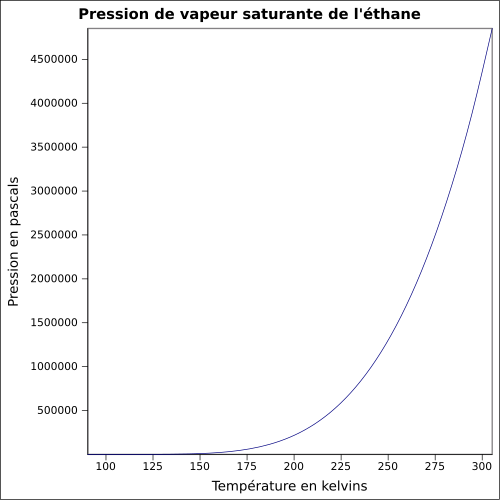
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Viscosidad dinámica | 63,4 mPo a -78,5 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto crítico |
32,15 ° C 49 bar 0,147 l · mol -1 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Triple punto |
−182,15 ° C 0,011 bares |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido |
1326 m · s -1 (líquido, -88,6 ° C ) 312 m · s -1 (gas, 27 ° C , 1 atm ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termoquímica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 líquido, 1 bar | 126,7 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 gas | -84,0 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ fus H ° | 0,583 kJ · mol -1 a -182,81 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ vapor H ° |
9,76 kJ · mol -1 a 25 ° C 14,703 kJ · mol -1 a -89,05 ° C |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C p |
52,49 J · mol -1 · K -1 ( 25 ° C , gas) 68,68 J · mol -1 · K -1 ( -173,15 ° C , líquido) ecuación:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCS | 1560,7 kJ · mol -1 ( 25 ° C , gas) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCI | 1437,11 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades electronicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 re energía de ionización | 11,56 ± 0,02 eV (gas) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cristalografía | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Clase de cristal o grupo espacial | P21 / n | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Parámetros de malla |
a = 4,226 Å b = 5.623 Å |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volumen | 190,10 Å 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Precauciones | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Peligro H220, H220 : gas extremadamente inflamable |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  A, B1, A : Temperatura crítica del gas comprimido = 32,27 ° C B1 : Límite inferior de inflamabilidad del gas inflamable = 3,0% Divulgación al 1,0% según los criterios de clasificación |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 1 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transporte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
23 : gas inflamable Número ONU : 1035 : Clase ETHANE : 2.1 Etiqueta: 2.1 : Gases inflamables (corresponde a los grupos designados con una F mayúscula); Embalaje: - 
223 : gas licuado refrigerado, inflamable Número ONU : 1961 : LÍQUIDO REFRIGERADO ETANO Clase: 2.1 Etiqueta: 2.1 : Gases inflamables (corresponde a los grupos designados con una F mayúscula); Embalaje: -  |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ecotoxicología | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 1,81 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unidades de SI y STP a menos que se indique lo contrario. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El etano es un hidrocarburo de la familia de los alcanos de fórmula empírica C 2 H 6. Es un gas combustible , incoloro e inodoro que se puede encontrar en el gas natural y también en los gases del petróleo .
usar
El etano es el reactivo básico para la síntesis de etileno mediante craqueo al vapor , monocloro- , 1,1-dicloro- y 1,1,1-tricloroetano mediante cloración . Combinando cloración con oxicloración , se puede sintetizar cloruro de vinilo y la reacción del etano con ácido nítrico en la fase gaseosa permite la formación de nitrometano y nitroetano .
El etano es un componente del gas de petróleo licuado, que es un combustible que se utiliza como sustituto del gas natural para aplicaciones particulares.
Propiedades fisicoquímicas
El etano se descompone a partir de una temperatura de 500 ° C . Su solubilidad en agua y en alcohol es mejor que la del metano ya que, a 20 ° C , es de 4,7 cm 3 por 100 cm 3 de agua y 150 cm 3 por 100 cm 3 de alcohol .
Producción y síntesis
El etano se deriva principalmente de la purificación de gas natural o se extrae del gas de petróleo licuado , una fracción del petróleo.
Transporte
Actualmente se transporta licuado, pero algún día también podría estar en forma de hidrato de etano ( clatrato ).
Ecología
El etano es un contaminante atmosférico clasificado entre los COV ( Compuesto orgánico volátil ).
Es uno de los precursores de la contaminación fotoquímica , que conduce en particular a la contaminación por ozono troposférico .
También se considera un trazador interesante porque está asociado con las emisiones geológicas de metano (gas de esquisto, gas natural, humos de petróleo ligero), pero no con las emisiones de metano biogénico (por lo que ha sido objeto de seguimiento en los últimos años. incluso desde el espacio) y modelado).
Emisiones naturales y antropogénicas
En la Tierra , medimos emisiones del orden de quince megatones de este gas a la atmósfera por año:
- volcanes de lodo , fuentes geotérmicas , cuencas de petróleo y fugas de gas en el fondo del océano liberan de dos a cuatro megatones ;
- alrededor de diez megatones provienen de incendios forestales , actividad biológica en los océanos, vida silvestre y humanos.
- una cantidad no medida hasta la fecha proviene de fugas de pozos, gasoductos e instalaciones de petróleo y gas y, en particular, gas de esquisto basado en fracturación hidráulica .
Etano y gas de esquisto
Un estudio publicado en mayo de 2015 en la revista Atmospheric Environment muestra que el etano es un buen trazador de fugas de gas vinculadas a la explotación de gas de esquisto. Estas fugas se pueden detectar a cientos de millas a favor del viento de las áreas de extracción, incluso en los Estados Unidos en estados que prohíben o controlan estrictamente el fracking .
Este estudio siguió las anomalías detectadas en el contenido de etano en el aire en los Estados Unidos a partir de 2010, donde se detectó en cantidades significativas en estados donde se suponía que no debía emitirse: si bien `` hubo una disminución general en las emisiones de COV no metano y una mejora en la calidad del aire desde 1996, el nivel de etano en el aire , de 2010 a 2013, aumentó drásticamente del 7 al 15% del carbono orgánico total sin metano en el aire, un aumento de “alrededor del 30 por ciento de 2010 a 2013 ” . En ese momento, las emisiones de metano no estaban suficientemente monitoreadas en el país para estar vinculadas a estas anomalías en el nivel de etano en el aire. Si bien nada en Maryland podría explicar el aumento en el nivel de etano, se descubrió rápidamente que los valores por hora medidos por las estaciones de monitoreo fotoquímico en Baltimore y Washington DC estaban fuertemente correlacionados con la dirección del viento y la evolución de las actividades de fracturación hidráulica en la cuenca de Marcellus ( donde el gas de esquisto se ha explotado a gran escala durante algunos años), a una gran distancia aguas arriba (en relación con el viento) del punto de medición. Los modelos meteorológicos (basados en la rosa de los vientos y la velocidad del viento) confirmaron que Maryland estaba expuesta a las columnas de humo de emisiones distantes de Pensilvania , Virginia Occidental y Ohio . En Maryland, los vientos predominantes se originan en la cuenca de Marcellus 2/3 del tiempo.
Los autores del estudio pudieron excluir de las causas todas las fuentes capaces de explicar la aparición de estos picos de etano en el aire (incluidos vehículos, fugas de gasoductos o almacenamiento de gas natural en el condado de Garrett , Maryland, ubicado a 155 millas del Área de estudio). Además, encontraron que el mismo análisis no reveló estos picos de etano para Atlanta , Georgia, que se encuentra en un área no afectada por el desarrollo generalizado de gas natural y sin nuevas operaciones de petróleo y gas. Este estudio confirma el trabajo anterior que muestra que subestimamos la contaminación por metano inducida por la explotación del gas de esquisto, y muestra que esta contaminación puede tener efectos distantes (sabiendo que el etano se considera aquí como un trazador de otros más nocivos ( mercurio ) o más. gases reactivos de pozos, pero también de instalaciones y obras de perforación, terminación, reactivación y seguridad al final de su vida útil ( óxidos de nitrógeno , contaminación por partículas, dióxido de azufre y vapores de hidrocarburos también fuentes de contaminación del aire).
Para R. Subramanian (investigador de Carnegie Mellon , especializado en el estudio de partículas atmosféricas, cuyo trabajo ha demostrado que el etano es un excelente marcador de las emisiones de metano provenientes de la explotación y transporte de gas natural), este estudio muestra la contribución potencial del gas de esquisto. extracción en Pensilvania a la calidad del aire en los estados de sotavento, y la necesidad de considerar el transporte interestatal de esta contaminación al formular regulaciones ambientales con respecto a la contaminación por partículas y el control del ozono a nivel del suelo .
Para Ehrman, estos resultados también son fuertes indicios de que ya no podemos hablar de contaminación local, sino de que existe un “problema regional” . Agrega que los autores querían con esta publicación "traer este tema a la atención del público, abogar por el monitoreo a largo plazo del metano y promover la cooperación regional en el monitoreo y reducción de emisiones de la producción de gas natural" .
Biodegradabilidad en la naturaleza
Los microbios metanotróficos se conocen desde hace varias décadas , especialmente en ciertos sedimentos marinos. Aunque la reacción bioquímica necesaria es compleja y termodinámicamente improbable, los investigadores creen que también puede haber microbios capaces de consumir etano (emitido en aproximadamente el 10% de las columnas de gas natural que se encuentran localmente en las profundidades marinas). superficie constituyen aproximadamente el 5% del metano atmosférico).
En el fondo marino se descubrió un primer microorganismo capaz de consumir etano en condición anaeróbica (publicación 2019): las arqueas Argoarcheum ethanivorans ; oxida el etano gracias a una simbiosis con otro microorganismo que le aporta oxígeno, en acción mutualista ( sintrofia ), reduciendo el sulfato a sulfuro .
Notas y referencias
- ETANO , la seguridad de hoja (s) del Programa Internacional para la Seguridad de Sustancias Químicas , consultado el 9 de mayo, 2009
- masa molecular calculada de " pesos atómicos de los elementos 2007 " en www.chem.qmul.ac.uk .
- Entrada "Etano" en la base de datos de productos químicos GESTIS de la IFA (organismo alemán responsable de la seguridad y salud en el trabajo) ( alemán , inglés ), consultado el 19 de abril de 2009 (se requiere JavaScript)
- “ ETANO ” , en Sustancias Peligrosas Data Bank (visitada 29 de de noviembre de, 2009 )
- (en) James E. Mark, Manual de propiedades físicas del polímero , Springer,2007, 2 nd ed. , 1076 p. ( ISBN 978-0-387-69002-5 y 0-387-69002-6 , leer en línea ) , pág. 294
- (en) Robert H. Perry y Donald W. verde , de Perry Ingenieros Químicos Handbook , EE.UU., McGraw-Hill,1997, 7 ª ed. , 2400 p. ( ISBN 0-07-049841-5 ) , pág. 2-50
- (en) "Ethane" , en NIST / WebBook , consultado el 11 de febrero de 2010
- (en) William M. Haynes , Manual CRC de Química y Física , Boca Raton, CRC Press / Taylor y Francis,1 er de julio de 2010, 91 ª ed. , 2610 p. ( ISBN 9781439820773 , presentación en línea ) , p. 14-40
- (en) Carl L. Yaws, Manual de diagramas termodinámicos: compuestos orgánicos C8 a C28 , vol. 1, Huston, Texas, Pub del Golfo. Co.,1996, 396 p. ( ISBN 0-88415-857-8 )
- (en) David R. Lide , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press,18 de junio de 2002, 83 ª ed. , 2664 p. ( ISBN 0849304830 , presentación en línea ) , p. 5-89
- (en) David R. Lide, Manual de química y física , Boca Raton, CRC,2008, 89 ª ed. , 2736 p. ( ISBN 978-1-4200-6679-1 ) , pág. 10-205
- “ etano ” , en www.reciprocalnet.org (visitada 12 de diciembre 2009 )
- Número de índice en la tabla 3.1 del apéndice VI del reglamento CE No. 1272/2008 (16 de diciembre de 2008)
- " Etano " en la base de datos de productos químicos Reptox de la CSST (organización de Quebec responsable de la seguridad y salud en el trabajo), consultado el 25 de abril de 2009
- "Etano" , en ESIS , consultado el 15 de febrero de 2009
- Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke, Enciclopedia de Química Industrial de Ullmann , Hidrocarburos , Wiley-VCH Verlag GmbH & Co,2000
- R. Kumar, P. Linga, I. Moudrakovski, JA Ripmeester y P. Englezos, Estructura y cinética de los hidratos de gas a partir de mezclas de metano / etano / propano relevantes para el diseño de instalaciones de transporte y almacenamiento de hidratos de gas natural. AlChE J. 2008; 54 (8), 2132-2144.
- Mirando al espacio para cuantificar las fugas de gas natural en la Tierra ; Phys.org 2015, Science X network, publicado el 24 de marzo de 2015, consultado el 2 de mayo de 2015
- Science & Vie, Sabemos lo que la Tierra desgasifica con hidrocarburos , nº 1098, marzo de 2009, p. 34.
- Vinciguerra, T & al. (2015) " Impactos regionales en la calidad del aire de la fracturación hidráulica y la actividad de gas natural de esquisto: evidencia de observaciones ambientales de COV ", Atmospheric Environment, Volumen 110, junio de 2015, páginas 144-150, ISSN 1352-2310, dx.doi.org/10.1016 /j.atmosenv.2015.03.056 ( resumen )
- News ( 1 st de mayo de 2015) Las emisiones de los pozos de gas natural puede viajar lejos a favor del viento , Phys.org, X Red de Ciencia
- Timothy Vinciguerra, Simon Yao, Joseph Dadzie, Alexa Chittams, Thomas Deskins, Sheryl Ehrman, Russell R. Dickerson (2015), Impactos regionales en la calidad del aire de la fracturación hidráulica y la actividad de gas natural de esquisto: evidencia de observaciones ambientales de COV; Atmospheric Environment Volumen 110, junio de 2015, páginas 144–150
- (2019) microbio que consume Elusive etano encuentran bajo el mar; Se ha descubierto un microorganismo que consume etano en ausencia de oxígeno ambiental. En las profundidades del mar, este microbio, que oxida el etano, se asocia con otro que reduce el sulfato a sulfuro , publicado el 27 de marzo por la revista Nature.
- Chen SC y col. , Oxidación anaeróbica de etano por arqueas de una filtración de hidrocarburos marinos. , DOI 2019 : 10.1038 / s41586-019-1063-0






