Glucósido cianogénico
Los glucósidos cianogénicos , cianoglucósidos o glucósidos cianogénicos son toxinas vegetales (fitotoxinas) muy extendidas, el grupo de los glucósidos . Consisten en un glucósido, que es la combinación de un alcohol y un carbohidrato (azúcar), que además lleva un grupo nitrilo -CN. La descomposición de este último por hidrólisis bajo el efecto de ciertas enzimas libera, entre otras cosas, cianuro de hidrógeno (HCN), una sustancia muy tóxica también llamada ácido cianhídrico (de ahí el nombre cianógeno). Este proceso se llama " cianogénesis ". Son metabolitos secundarios de las plantas que, en particular, proporcionan funciones de defensa a las plantas contra sus depredadores herbívoros o fitófagos.
Estos compuestos, que pueden definirse químicamente como glucósidos de α-hidroxinitrilos , se derivan de aminoácidos que son constituyentes de plantas. Están presentes en más de 2.500 especies vegetales.
Algunos "tipos biosintéticos" de glucósidos cianogénicos parecen tener múltiples orígenes evolutivos, mientras que otros parecen haber ocurrido solo una vez y, por lo tanto, tienen una distribución limitada a unos pocos taxones de plantas relacionados.
- Los glucósidos cianogénicos derivados de aminoácidos ramificados son comunes en las subfamilias Amygdaloideae y Maloideae entre las Rosáceas ; y compuestos similares se encuentran en Fabaceae y Sapindaceae .
- Los glucósidos cianogénicos derivados de la tirosina son comunes en muchas familias de Magnoliales y Laurales .
Estructura
Los glucósidos cianogénicos son moléculas formadas por dos elementos: la aglicona, una parte no carbohidrato, formada por cianohidrina (α-hidroxinitrilo), estabilizada por un azúcar (o osa), a menudo glucosa, que constituye la glicona. Su estructura es variada, se conocen más de 60 formas diferentes, las diferencias surgen de variaciones de la aglicona o de una glicosilación adicional de la glicona. El átomo de carbono central a menudo es asimétrico , por lo tanto, la estructura es quiral y puede presentarse tanto en la forma R como en la S ( enantiómeros ).
Con pocas excepciones, los glucósidos cianogénicos conocidos se dividen en seis grupos, derivados de cinco aminoácidos proteicos ( valina , isoleucina , leucina , fenilalanina y tirosina ) y un aminoácido no proteico ( ciclopenteniglicina ).
| Precursores | Estructuras basicas | Ejemplos de derivados |
|---|---|---|
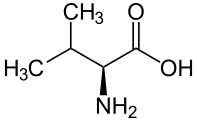 Valina |
Linamarina | Linustatin |
 Isoleucina |
R- Lotaustralin , S- Neolotaustralin |
Neolinustatina |
 Leucina |
R- Heterodendrin , S- Epiheterodendrin |
Proacacipetaline , Cardiospermine , Proacaciberin |
| Ciclopenteniglicina | R- Deidaclin , S- Tetrafilina A |
Taraktophylline , Gynocardine |
 Fenilalanina |
R- Prunasina , S- Sambunigrina |
La amígdala , Holocalin , Vicianine |
 Tirosina |
R- Dhurrine , S- Taxifilina |
Proteína , nandina |
Distribución
Se ha reconocido la presencia de glucósidos cianogénicos en al menos 2650 especies de plantas, en más de 550 géneros y 130 familias . Esta detección se basa en pruebas colorimétricas simples, pero los compuestos cianogénicos se han aislado y estudiado en alrededor de 475 especies de plantas, y la estructura química de estos compuestos se ha publicado solo en 60 casos. La mayoría de las familias en cuestión pertenecen a las angiospermas , principalmente las dicotiledóneas , pero existen excepciones como las Polypodiaceae ( pteridofitas ) y las Taxaceae ( gimnospermas ).
Ciertos glucósidos cianogénicos tienen una amplia distribución y están presentes en muchas familias de plantas. Así, la linamarina y la lotaustralina se encuentran en cinco familias: Asteraceae , Euphorbiaceae , Linaceae , Papaveraceae y Fabaceae , mientras que la prunasina está presente en seis familias ( Polypodiaceae , Myrtaceae , Rosaceae , Saxifragaceae , Scrophulariaceae y Myoporaceae ). El caso más general es que un compuesto cianogénico particular aparece solo en una o dos familias. Por el contrario, la mayoría de las veces, una familia determinada contiene solo uno o dos glucósidos característicos. Este es el caso, por ejemplo, de las Poaceae ( dhurrine ), las Asteraceae ( linamarin ), las Polypodiaceae ( prunasin y vicianin ), las Rosáceas ( amygdalin y prunasin). Esta distribución particular confiere a estos compuestos un carácter quimiotaxinómico .
Muchas especies de bacterias y hongos también tienen compuestos cianogénicos, pero estos son generalmente lábiles .
En el reino animal, la presencia de glucósidos cianogénicos parece limitarse a los artrópodos . Ciertos insectos , a menudo con coloración aposemática , pueden sintetizar estas sustancias cianogénicas de novo o secuestrarlas de sus plantas hospedadoras.
Ejemplos de
| Glucósido cianogénico | Especies de plantas | |
|---|---|---|
| Nombre vernáculo | Nombre científico | |
| Amigdalina | Almendro (almendras) | Prunus amygdalus |
| Dhurrine | Sorgo | Sorgo bicolor , Álbum de sorgo |
| Linamarina | Mandioca | Manihot esculenta , Manihot carthaginensis |
| haba | Phaseolus lunatus | |
| Lotaustralin | Mandioca | Manihot carthaginensis |
| haba | Phaseolus lunatus | |
| Prunasina | Fruta de piedra |
Prunus spp., Por ejemplo: Prunus avium , Prunus padus , Prunus persica , Prunus macrophylla |
| Taxifilina | Brote de bambú | Bambusa vulgaris |
Polimorfismo de la cianogénesis en trébol blanco
Conocemos en Europa desde hace casi un siglo, un polimorfismo genético de cianogénesis en diversas poblaciones de trébol blanco ( Trifolum repens ). Este polimorfismo, que se manifiesta por la liberación o no de cianuro en caso de daño a los tejidos de las plantas y bajo el efecto de la enzima correspondiente, está controlado por dos genes independientes, Ac y Li.
El gen Ac determina la capacidad de la planta para producir glucósidos cianogénicos ( lotaustralin y linamarin ). Estos glucósidos se almacenan en las vacuolas de las hojas y las células madre. Una planta debe portar al menos un alelo Ac dominante para producir glucósidos cianogénicos, una planta homocigótica recesiva (genotipo acac) no lo hace.
El gen Li determina la presencia o ausencia de la enzima linamarasa , que es necesaria para la hidrólisis de glucósidos cianogénicos y la liberación de cianuro, por lo que es más peligrosa. La linamarasa se almacena en la pared de las células epidérmicas de las hojas, por lo que solo cuando las células se descomponen, la enzima puede entrar en contacto con los glucósidos y puede producirse la liberación de cianuro. Una planta que porta dos alelos recesivos del gen Li (genotipo lili) no produce linamarasa.
Por tanto, existen cuatro tipos diferentes de trébol en relación con su potencial toxicidad por cianogénesis. El fenotipo cianogénico está determinado por la presencia de un alelo dominante en cada locus:
- AcLi: glucósidos y enzima,
- Acli: solo glucósidos,
- acLi: enzima solamente,
- acli: ni glucósidos ni enzima.
Solo cuando ambos genes son dominantes es posible que se produzca un efecto tóxico. En otros casos, los glucósidos o la enzima o ambos están ausentes y la planta no puede liberar cianuro (planta acianógena).
usar
La prunasina y la amidalina contenidas en las hojas frescas del almendro o del laurel cereza se consideran tradicionalmente como sustancias activas en la medicina herbal . Se les atribuyen propiedades anestésicas y antiespasmódicas en dermatología.
De hojas frescas de laurel cereza ( Prunus laurocerasus ), que son ricas en prunasina (120 a 180 mg / 100 g), “agua destilada de laurel cereza”, titulada a 100 mg / 100 g de HCN total. Esta preparación se inscribió en la farmacopea francesa ( décima edición) y se usó como aromatizante, antiespasmódico y estimulante respiratorio.
Notas y referencias
- (en) Hegnauer R., " compuestos cianogénicos como marcadores sistemáticos en Tracheophyta " , Plant Syst Evol. , vol. Supl 1,1977, p. 191-209.
- (en) David S. Seigler, “ los glucósidos cianogénicos y Cyanolipids ” , en la planta secundaria Metabolismo , Springer Science & Business Media,1998, 759 p. ( ISBN 9780412019814 , leer en línea ) , pág. 273-299.
- (en) Michael Wink, Bioquímica de vegetales secundarias Metabolism , t. 2, CRC Press, coll. "Revisiones anuales de plantas de Sheffield",1999, 374 p. ( ISBN 978-0-8493-4085-7 , leer en línea ) , pág. 79-106.
- (en) János Vetter, “ glucósidos cianogénicos de la planta ” , Toxicon , vol. 38, n o 1,enero 2000, p. 11-36 ( leer en línea ).
- (en) Matthias Lechtenberg, " Cianogénesis en plantas y animales superiores " , eLS , John Wiley & Sons,julio 2011( DOI 10.1002 / 9780470015902.a0001921.pub2 , resumen ).
- (in) Mika Zagrobelny Søren Baka Anne Vinther Rasmussen, Bodil Jørgensen, Clas Naumann, Birger Lindberg Møller, " Glucósidos cianogénicos e interacciones planta-insecto " , Fitoquímica , vol. sesenta y cinco,2004, p. 293–306 ( leer en línea ).
- (en) G. Speijers, " cyanogenic glycosides " en IPCS INCHEM , Programa Internacional de Seguridad Química (IPCS) (consultado el 13 de diciembre de 2016 )
- (en) MA Hughes, " El polimorfismo cianogénico en Trifoliumrepens L. (trébol blanco) " , Heredity , vol. 66,1991, p. 105-115 ( leer en línea ).
- " Variación de las poblaciones naturales " (consultado el 14 de diciembre de 2016 ) .
- (En) " Laboratorio: cianogénesis del trébol " , en Artes y ciencias , Universidad de Washington en St. Louis,septiembre 2012(consultado el 14 de diciembre de 2016 ) .
- Émilie Lebreton, “ Plantas para uso cutáneo en niños (tesis) ” , Université Joseph Fourier - UFR de pharmacy de Grenoble = (consultado el 15 de diciembre de 2016 ) .
- Jean Bruneton, Farmacognosia, fitoquímica, plantas medicinales (4a ed.) , Lavoisier,2009, 1292 p. ( ISBN 978-2-7430-1904-4 , leer en línea ).
Ver también
Bibliografía
- (en) Judd, WS Campbell, CS Kellogg, EA Stevens, PF Donoghue, MJ, “ Secondary Plant Compounds (chap. 4, Structural and Biochemical Characters) ” , en Plant systematics: a phylogenetic approach, Second Edition , Sunderland (Massachusetts, Asociados Sinauer,2002, 576 p..
- ( fr ) Jonathan E. Poulton, " Cianogénesis en plantas " , Plant Physiol. , vol. 94,1990, p. 401-405 ( leer en línea ).
- (en) János Vetter, “ Plant cyanogenic glycosides ” , Toxicon , vol. 38, n o 1,enero 2000, p. 11-36 ( leer en línea ).
- (en) Ilza A. Francisco y Maria Helena Pimenta Pinotti, “ Glucósidos cianogénicos en plantas ” , Archivo Brasileño de Biología y Tecnología , vol. 43, n o 5,2000( ISSN 1678-4324 , leer en línea ).
- (en) David S. Seigler, " Glucósidos cianogénicos y cianolípidos " , en Plant Secondary Metabolism , Springer Science & Business Media,1998, 759 p. ( ISBN 9780412019814 , leer en línea ) , pág. 273-299.
enlaces externos
- (en) “ Cyanogenic Glycosides - Information sheet ” , MPI Food Safety , Ministerio de Industrias Primarias (Nueva Zelanda) (consultado el 12 de diciembre de 2016 ) .