Trimetilaluminio
| Trimetilaluminio | |
| |
| Trimetilaluminio | |
| Identificación | |
|---|---|
| Nombre IUPAC | Trimetilalano |
| Sinónimos |
trimetil-aluminio |
| N o CAS | |
| N o ECHA | 100.000.776 |
| N o EC | 200-853-0 |
| N o RTECS | BD2204000 |
| PubChem | 16682925 |
| Sonrisas |
C [Al] (C) ([CH3] 1) [CH3] [Al] 1 (C) C , |
| InChI |
Std. InChI: InChI = 1S / 3CH3.Al / h3 * 1H3; Std. InChIKey: JLTRXTDYQLMHGR-UHFFFAOYSA-N |
| Apariencia | líquido pirofórico incoloro |
| Propiedades químicas | |
| Fórmula bruta |
C 6 H 18 Al 2 [Isómeros] |
| Masa molar | 144.1702 ± 0.0061 g / mol C 49.99%, H 12.58%, Al 37.43%, |
| Propiedades físicas | |
| T ° fusión | 15 ° C |
| T ° hirviendo | 125 hasta 126 ° C |
| Solubilidad | 2790 mg · l -1 |
| Densidad | 0,752 g · cm -3 ( 25 ° C ) |
| punto de inflamabilidad | −17 ° C (vaso cerrado) |
| Presión de vapor saturante | 92,4 hPa ( 60 ° C ) |
| Precauciones | |
| SGH | |
  H250, H260, H314, P222, P223, P280, P231 + P232, P370 + P378, P422,
H250 : Se incendia espontáneamente en contacto con el aire
H250, H260, H314, P222, P223, P280, P231 + P232, P370 + P378, P422,
H250 : Se incendia espontáneamente en contacto con el aire H260 : En contacto con el agua libera gases inflamables que pueden encenderse espontáneamente H314 : Provoca quemaduras graves en la piel y lesiones oculares P222 : No permitir que entre en contacto con el aire. P223 : Evite el contacto con el agua, debido al riesgo de reacción violenta e ignición espontánea. P280 : Use guantes de protección / ropa protectora / protección para los ojos / protección facial. P231 + P232 : Manipular bajo gas inerte. Proteger de la humedad. P370 + P378 : En caso de incendio: Utilizar… para apagarlo. P422 : Almacenar contenido en ... |
|
| WHMIS | |
 B6, |
|
| NFPA 704 | |
| 3 3 3 | |
| Ecotoxicologia | |
| LogP | 1.970 |
| Unidades de SI y STP a menos que se indique lo contrario. | |
El trimetilaluminio (o trimetilaluminio ) es un compuesto químico de fórmula Al 2 ( CH 3 ) 6 , abreviado como Al 2 Me 6 (AlMe 3 ) 2 o TMA.
Es una molécula de la familia del organoaluminio , pirofórico (que arde al contacto con el aire), y que aparece como un líquido casi incoloro a temperatura ambiente, produciendo humo blanco (partículas de óxido de aluminio).
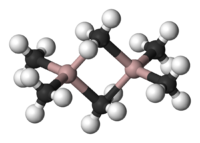
Estructura química
El Al 2 Me 6 existe como un dímero , análogo (por su estructura y sus enlaces) al diborano . Como en el caso del diborano, las moléculas están conectadas por dos enlaces con tres centros y dos electrones a través del puente de metileno compartido entre los dos grupos de átomos de aluminio. Cada uno de los átomos de carbono de los grupos metilo está rodeado por cinco átomos vecinos: tres átomos de hidrógeno y dos átomos de aluminio . Los grupos metilo intercambian fácilmente su posición dentro de la misma molécula y entre diferentes moléculas.
Síntesis y aplicaciones
El TMA se prepara mediante un proceso de dos pasos que se puede resumir de la siguiente manera:
2 Al + 6 CH 3 Cl + 6 Na → Al 2 (CH 3 ) 6 + 6 NaCl.El TMA se utiliza principalmente para la producción de metilaluminoxano (Al (CH 3 ) O) n ), un activador de la reacción de Ziegler-Natta de catálisis heterogénea para la polimerización de olefinas . Por tanto, se utiliza TMA como agente metilante . El reactivo de Tebbe utilizado para la metilenación de ésteres y cetonas , y se prepara a partir de TMA. El TMA a menudo se libera de los cohetes que suenan para producir humo blanco que se utiliza como trazador en estudios de patrones de viento en la atmósfera superior.
TMA se utiliza también en la fabricación de ciertos de película delgada de semiconductores , en particular, “ high-k dieléctricos ” tal como Al 2 O 3 a través de vapor químico de deposición o deposición de película delgada atómicas procesos .
El TMA forma un complejo con la amina terciaria DABCO , que es más seguro de manejar que el propio TMA.
En combinación con Cp 2 ZrCl 2 ( dicloruro de circonoceno ), el grupo (CH 3 ) 2 Al-CH 3 produce una reacción de carboaluminización .
La NASA (Misión ATREX para Experimento de Cohetes de Transporte Anómalo ) usó humo blanco que forma contacto con el aire por el TMA para estudiar la " corriente en chorro " de gran altitud.
TMA y semiconductores
El TMA se ha convertido en la fuente organometálica preferida de los productores de semiconductores para la epitaxia en fase vapor organometálica (o MOVPE ). El criterio de calidad de TMA es entonces su contenido de impurezas elementales e impurezas (oxigenadas y / u orgánicas), que debe ser lo más bajo posible.
Ver también
Artículos relacionados
enlaces externos
- (en) Enlace comercial informativo sobre trimetilaluminio y otros organometálicos .
- (es) Cuadro interactivo de presión de vapor para metalorgánicos .
- (en) Artículo de la misión ATREX de la NASA .
Notas y referencias
- masa molecular calculada de " pesos atómicos de los elementos 2007 " en www.chem.qmul.ac.uk .
- Hoja Sigma-Aldrich del compuesto Trimethylaluminum , consultada el 27 de agosto de 2012.
- (en) " trimetilaluminio " en ChemIDplus visitado en agosto de 2012 237
- archivo CSST
- (en) Holleman, AF; Wiberg, E., Química inorgánica , San Diego, Academic Press ,2001( ISBN 0-12-352651-5 )
- (en) Biswas, K.; Prieto, O.; Goldsmith, PJ; Woodward, S., “ Adiciones notablemente estables (Me 3 Al) 2 · DABCO y AlR 3 (R = Me, Et) catalizadas con níquel estereoselectivo a aldehídos ” , Angewandte Chemie International Edition , vol. 44, n o 15, 2005, p. 2232–2234 ( PMID 15768433 , DOI 10.1002 / anie.200462569 )
- (en) Negishi, E.; Matsushita, H., Síntesis de 1,4-dienos catalizada por paladio mediante alilación de alquenyalano: α-Farneseno [1,3,6,10-Dodecatetraeno, 3,7,11-trimetil-] , Org. Synth. 62 , col. " Vuelo. 7 ",1984, 31 p. , p. 245
