Tiobenzofenona
| Tiobenzofenona | ||
| ||
 | ||
| Identificación | ||
|---|---|---|
| Nombre IUPAC | difenilmetanotiona | |
| Sinónimos |
benzotiona |
|
| N o CAS | ||
| PubChem | 578536 | |
| Sonrisas |
S = C (c1ccccc1) c2ccccc2 , |
|
| InChI |
InChI: InChI = 1S / C13H10S / c14-13 (11-7-3-1-4-8-11) 12-9-5-2-6-10-12 / h1-10H InChIKey: XDDVRYDDMGRFAZ-UHFFFAOYSA -NO |
|
| Apariencia | cristales azules | |
| Propiedades químicas | ||
| Fórmula bruta |
C 13 H 10 S [Isómeros] |
|
| Masa molar | 198,284 ± 0,016 g / mol C 78,75%, H 5,08%, S 16,17%, |
|
| Propiedades físicas | ||
| T ° fusión | 53-54 ° C | |
| T ° hirviendo | 174 ° C a 14 mmHg | |
| Unidades de SI y STP a menos que se indique lo contrario. | ||
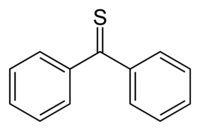
La tiobenzofenona es un azufre compuesto orgánico de fórmula estructural (C 6 H 5 ) 2 C = S. Es una tiocetona prototípica porque, a diferencia de la mayoría de las otras tiocetonas que tienden a dimerizarse u oligomerizarse para formar anillos y polímeros , la tiobenzofenona es relativamente estable aunque tiende a fotoxidarse en el aire para restaurar la benzofenona y el azufre . La tiobenzofenona es de color azul oscuro y se disuelve fácilmente en muchos disolventes orgánicos .
Síntesis
Una de las primeras síntesis informadas de tiobenzofenona implica la reacción de sulfuro de hidrógeno de sodio , Na H S y diclorobenzofenona:
Ph 2 CCl 2 + 2 NaSH → Ph 2 C = S + 2 NaCl + H 2 SOtro método más conveniente, adaptado de la secuencia anterior y que da resultados más reproducibles, implica el uso de benzofenona como material de partida:
Ph 2 C = O + H 2 S → Ph 2 C = S + H 2 OUna mezcla gaseosa de cloruro de hidrógeno , HCl y sulfuro de hidrógeno , H 2 S, se introduce en una solución enfriada de benzofenona en etanol .
La tiobenzofenona también se puede producir mediante una reacción de Friedel-Crafts de cloruro de tiobenzoílo sobre benceno .
Estructura
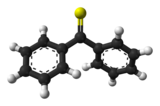
De acuerdo con la regla del doble enlace (en) , el doble enlace C = S de la mayoría de las tiocetonas es inestable con respecto a la dimerización, lo que hace que la tiobenzofenona sea aún más valiosa para el estudio del enlace C = S y de su química. La diferencia de energía entre los orbitales p del azufre y los del carbono es mayor que entre el oxígeno y el carbono en las cetonas . Las diferencias relativas en energía y en la extensión de los orbitales p del azufre y el carbono inducen una mala superposición de los orbitales y, por lo tanto, la diferencia de energía entre HOMO y LUMO es menor para C = S que para C = O. Esto también explica el llamativo color azul de la tiobenzofenona, que se debe a una transición π → π * que absorbe la luz en un pico de longitud de onda de 314,5 nm . La longitud del enlace C = S en la tiobenzofenona es de 163 μm (1,63 Å ) que es comparable a 164 μm del enlace C = S del tioformaldehído, CH 2 = S, medido en la fase gaseosa. Debido a las interacciones estéricas , los grupos fenilo no son coplanares y el ángulo diedro SC-CC es de 36 °. Finalmente, también se han preparado muchas otras tiones de estructura y estabilidad relacionadas con la tiobenzofenona, tales como 4,4'-bis (dimetilamino) tiobenzofenona .
Reacción
Debido a la debilidad del doble enlace C = S en comparación con C = O, la tiobenzofenona es más reactiva que su contraparte oxigenada, la benzofenona . Las tiobenzofenonas, así como otras tiocetonas, se consideran superdipolarófilos y, por tanto, buenos dienófilos que se combinan cuantitativa y rápidamente con 1,3- dienos en cicloadiciones de Diels-Alder . La reactividad de las tiones en estas cicloadiciones está relacionada, entre otras cosas, con la altura de la brecha de energía pequeña entre HOMO y LUMO de π-OM ( orbitales moleculares π) del doble enlace C = S.
Las reacciones entre la tiobenzofenona y la mayoría de los dienos dan lugar a aductos de Diels-Alder, mientras que las reacciones con monoolefinas ( alqueno simple) dan lugar a compuestos bicíclicos .
Notas y referencias
- ( fr ) Este artículo está tomado parcial o totalmente del artículo de Wikipedia en inglés titulado " Thiobenzophenone " ( consulte la lista de autores ) .
- H. Staudinger, H. Freudenberg, tiobenzofenona , Org. Synth. 11 , col. " Vuelo. 2 ",1931, 94 p. , p. 573
- masa molecular calculada de " pesos atómicos de los elementos 2007 " en www.chem.qmul.ac.uk .
- B. F. Gofton, EA Braude, tiobenzofenona , Org. Synth. 35 , col. " Vuelo. 4 ",1955, 97 p. , p. 973
- Patrick Metzner, Tiocarbonilo compuestos como herramientas específicas para la Síntesis Orgánica , organosulfur Química I: Temas en la Current Chemistry, 1999, vol. 204/1999, págs. 127-181. DOI : 10.1007 / 3-540-48956-8_2 .
- Horst Viola, Steffen Scheithauer, Roland Mayer, Organische Schwefelverbindungen, 97. Friedel-Crafts-Reaktionen mit Thiosäurechloriden , Chem. Ber., 1968, vol. 101, págs. 3517–3529. DOI : 10.1002 / cber.19681011024
- L. Fišera, R. Huisgen, I. Kalwinsch, E. Langhals, X. Li, G. Mloston, K. Polborn, J. Rapp, W. Sicking, R. Sustmann, New Thione Química , Pure & Appl. Chem., 1996, vol. 68, págs. 789-798. DOI : 10.1351 / pac199668040789 .
- R. Sustmann, W. Sicking, R. Huisgen, Un estudio computacional de la cicloadición de tiobenzofenona S-metiluro a tiobenzofenona , J. Am. Chem. Soc. , 2003, vol. 125, págs. 14425-14434. DOI : 10.1021 / ja0377551 .
- Donald C. Dittmer, Eric S. Whitman, Adición de tiobenzofenona al 2-carboxilato de bencenodiazonio , J. Org. Chem. , 1969, vol. 34 (6), págs. 2004–2006. DOI : 10.1021 / jo01258a118 .
- Riaz Ahmed, Walter Lwowski, Reacción de aniones cetimina con compuestos de carbonilo y tiocarbonilo , Tetrahedron Letters , 1969, vol. 10 (41), págs. 3611–3612. DOI : 10.1016 / S0040-4039 (01) 88467-7 .
- K. Okuma, T. Yamamoto, T. Shirokawa, T. Kitamura, Y. Fujiwara, El primer aislamiento de aductos de bencina-tiobenzofenona , Tetrahedron Letters, 1996, vol. 37 (49), págs. 8883-8886. DOI | 10.1016 / S0040-4039 (96) 02074-6.