Smad 4
Smad4 o Madres contra el homólogo 4 decapentapléjico es una proteína que contiene 552 aminoácidos.
Descripción de la proteína
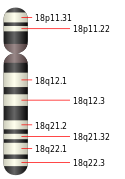





Está codificado por el cromosoma 18 humano más precisamente en la región 18q21.1. El peso de esto es 60439 Da . El nombre Smad proviene de dos proteínas, MAD que proviene de Drosophila y SMA, que es una proteína del nematodo C.elegans . Durante los estudios sobre Drosophila, algunos investigadores descubrieron una mutación en el gen MAD. Esta mutación se transmitió de la madre Drosophila a su embrión en forma de "decapentaplejía", es decir, una forma de parálisis. Es por esta razón que la proteína Smad significa “parecida a la madre versus decapentaplejía”. También existen otros nombres que algunos autores le dan a esta proteína como: DPC4, JIP, MAD, MADH4.
Smad 4 es parte de la taxonomía del Homo sapiens. Es omnipresente en las células de la piel, páncreas, colon, útero, epitelio y fibroblastos. También tiene dos sitios de sumoilación, uno mayor posicionado en lisina 159 y un menor en lisina 113. La adición de una proteína SUMO aumenta la estabilidad de Smad 4.
Smad 4 es parte de la familia Smads . Desempeña el papel de factor de transducción y transcripción de señales. Se localiza en el citoplasma de la célula y se transporta al núcleo para llevar a cabo su acción. Por tanto, se puede decir que esta proteína es un efector intracelular.
Mecanismo de acción de Smad 4
El ligando respectivo se une al receptor de Smads, que es un receptor de serina / treonina quinasa. Luego, Smad 2 y Smad 3 se fosforilan debido a la activación del receptor tipo 1. Posteriormente se formará un complejo con Smad 4. Este complejo heterodimérico de Smad 4 y Smads se transloca al núcleo, donde puede regular la transcripción de genes específicos implicados en el control y regulación del crecimiento celular. En resumen, la proteína Smad 4 es fundamental en la regulación del crecimiento celular a través de la vía TGF-β, a continuación se ilustran las diferentes etapas del mecanismo de acción.
Patologías
Las patologías asociadas a esta proteína están ligadas al TGF-β. Si hay una mutación en el gen que codifica la proteína Smad 4, la transcripción de TGF-β no tendrá lugar, por lo que habrá crecimiento celular sin inhibición. Este crecimiento conducirá a la aparición de tumores y ciertos cánceres a más largo plazo. Por ejemplo, dado que la proteína Smad 4 está presente en las células del páncreas y del colon, existe la posibilidad de desarrollar cáncer colorrectal o carcinoma pancreático. El síndrome de poliposia juvenil también puede ser consecuencia de una mutación en el gen que codifica la proteína Smad 4. Una deleción en el gen de esta proteína puede conducir a la inactivación de Smad 4 y, en consecuencia, conducir al cáncer de mama. Todos estos son ejemplos que muestran la utilidad y el papel principal de Smad 4 en la transcripción de TGF-β.
Otro ejemplo de patología vinculada a un virus
El VPH, el virus del papiloma humano, es un miembro de la familia del papovavirus. El virus del papiloma humano expresa una oncoproteína E7. Esta oncoproteína está implicada en la causa de los cánceres de cuello uterino asociados con la infección por VPH.
Primero, la oncoproteína se une a Smad 1, 2, 3 y 4. Esto bloqueará la interacción del complejo Smad. Por lo tanto, este complejo ya no podrá translocarse al núcleo y generar la transcripción de TGF-β. Si no hay más formación de TGF-β, la célula continuará creciendo ya que ya no tendrá una señal inhibidora. Por tanto, habrá desarrollo de un tumor y, a largo plazo, de cáncer.
Notas y referencias
- Dr. Xi-Hua Feng, modificación SUMO-1 en Smad 4 / DPC4, Houston, JBC Papers in Press, 2003
- Massague J, Wotton D, Control transcripcional por el sistema de señalización TGF-beta / Smad, EMBO J, 2000
- Roelen BA, La fosforilación de treonina 276 en SMAD4 está involucrada en la acumulación nuclear inducida por TGF-B, Boston, 2003
- Kitamura T, tumores intestinales deficientes en SMAD4 reclutan CCR1, E pub, Kyoto, 2007
- Chow E, Macrae F, Una revisión del síndrome de poliposis juvenil, J. Gastroenterol Hepatol, 2005
- Dug Keun Lee, El virus del papiloma humano E7 […], Houston, JBC Papers in Press, 2002
otras referencias
- Diansheng Zhong, deleción homocigótica de Smad 4 en cáncer de mama, Estados Unidos, Landes Bioscience, 2002
- Audrey EK Hutcheon, Efecto del tipo de herida en la translocación de Smad 2 y 4, Boston, 2005