Trifluoruro de cloro
| Trifluoruro de cloro | |||
|
|||
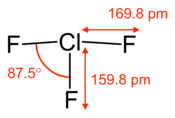
| Estructura del trifluoruro de cloro. | |||
| Identificación | |||
|---|---|---|---|
| N o CAS | |||
| N o ECHA | 100,029,301 | ||
| N o CE | 232-230-4 | ||
| N o RTECS | FO2800000 | ||
| PubChem | 24637 | ||
| CHEBI | 30123 | ||
| Sonrisas |
FCl (F) F , |
||
| InChI |
Std. InChI: InChI = 1S / ClF3 / c2-1 (3) 4 Std. InChIKey: JOHWNGGYGAVMGU-UHFFFAOYSA-N |
||
| Apariencia | Gas o líquido amarillento | ||
| Propiedades químicas | |||
| Fórmula bruta | ClF 3 | ||
| Masa molar | 92,448 ± 0,002 g / mol Cl 38,35%, F 61,65%, |
||
| Momento dipolar | 0,6 ± 0,1 D | ||
| Propiedades físicas | |||
| T ° fusión | −76,31 ° C | ||
| T ° hirviendo | 11,8 ° C | ||
| Densidad | 3,57 kg · m -3 a 0 ° C y 101,3 kPa | ||
| Presión de vapor saturante | 141,9 kPa a 20 ° C | ||
| Punto crítico | 174,0 ° C ; 5,78 MPa ; 0,548 g · cm -3 | ||
| Triple punto | −76,3 ° C | ||
| Termoquímica | |||
| Δ vapor H ° | 27,53 kJ · mol -1 ( 1 atm , 11,75 ° C ) | ||
| Precauciones | |||
| SGH | |||
    Peligro H270, H280, H314, H330, H370, H372, H400, H270 : Puede provocar o agravar un incendio; comburente H280 : Contiene gas a presión; puede explotar si se calienta H314 : Provoca quemaduras graves en la piel y lesiones oculares H330 : Mortal en caso de inhalación H370 : Provoca daños en los órganos (o enumere todos los órganos afectados, si se conocen) (indique la vía de exposición si se ha demostrado de manera concluyente que no hay otra vía exposición conduce al mismo peligro) H372 : Riesgo demostrado de daño grave a los órganos (indicar todos los órganos afectados, si se conocen) tras una exposición repetida o prolongada (indicar la vía de exposición si se ha demostrado de manera concluyente que ninguna el mismo peligro) H400 : Muy tóxico para los organismos acuáticos |
|||
| Transporte | |||
265 : gas venenoso y oxidante (promueve el fuego) Número ONU : 1749 : TRIFLUORURO DE CLORO Clase: 2.3 Etiquetas: 2.3 : Gases tóxicos (corresponde a los grupos designados con una T mayúscula, es decir, T, TF, TC, TO, TFC y TOC). 5.1 : Sustancias comburentes 8 : Sustancias corrosivas Envasado: -    |
|||
| Unidades de SI y STP a menos que se indique lo contrario. | |||
El trifluoruro de cloro es un interhalógeno de fórmula ClF 3. Es un gas incoloro, muy oxidante y extremadamente reactivo, corrosivo y tóxico, que se condensa en un líquido amarillo verdoso. Se encuentra con mayor frecuencia en el mercado en su forma líquida presurizada a temperatura ambiente. Se utiliza principalmente en las fases de limpieza y para el grabado químico en la industria de los semiconductores y en algunos otros procesos industriales. Se utiliza en particular en el ciclo del combustible nuclear , donde permite la conversión de compuestos de uranio fluorado no volátil en hexafluoruro de uranio UF 6, un compuesto con interesantes propiedades físicas desde el punto de vista de los procesos de enriquecimiento de uranio :
Ahora se abandona su uso como oxidante para la propulsión espacial dados los riesgos reales para los equipos y para las tripulaciones; por otro lado, es la materia prima para la síntesis de pentafluoruro de cloro ClF 5, un propulsor que se utiliza a veces, la mayoría de las veces con hidracina , para la propulsión de ciertos misiles.
Preparación y propiedades
El trifluoruro de cloro fue preparado por primera vez en 1931 por dos químicos alemanes, O. Ruff y H. Kug, haciendo reaccionar flúor F 2sobre cloro Cl 2, que también produjo monofluoruro de cloro ClF, separado del trifluoruro por destilación:
3 F 2+ Cl 2→ 2 ClF 3La molécula de ClF 3tiene forma de T, que la teoría VSEPR explica bien:
- el átomo de cloro está en el centro de la molécula
- una de las tres posiciones ecuatoriales está ocupada por un átomo de flúor unido al cloro por un enlace covalente
- las otras dos posiciones ecuatoriales están ocupadas por un doblete no vinculante
- las dos posiciones axiales están ocupadas cada una por un átomo de flúor formando, con el átomo de cloro central , un enlace con tres centros y cuatro electrones , normalmente rectilíneo pero aquí un poco plegado bajo el efecto de los dos dobletes no ligantes.
Por lo tanto, los tres átomos de flúor están unidos al cloro por enlaces de diferente tipo, lo que da como resultado diferentes longitudes de enlace:
- ~ 159,8 µm para el enlace Cl-F ecuatorial ( covalente )
- ~ 169.8 pm para enlaces axiales Cl-F (que participan en el enlace 3c-4e )
El trifluoruro de cloro puro es estable hasta 180 ° C , pero se descompone en F 2y Cl 2 por encima de esta temperatura.
Es un oxidante muy enérgico así como un agente fluorante. Muy reactivo con la mayoría de las materias orgánicas y minerales, es probable que provoque la combustión de forma espontánea, a veces explosiva. El metal suele dar cloruros y fluoruros , el fósforo da tricloruro de fósforo PCl 3y pentafluoruro de fósforo PF 5, mientras que el azufre da dicloruro de azufre SCl 2así como tetrafluoruro de azufre SF 4. A temperatura ambiente, sulfuro de hidrógeno H 2 Sexplota en contacto con trifluoruro de cloro, que también se hidroliza violentamente en contacto con agua H 2 Oliberando un conjunto de compuestos peligrosos, comenzando con el fluoruro de hidrógeno HF.
Riesgos
Dado que el trifluoruro de cloro es más oxidante que el oxígeno mismo, puede corroer la cerámica y varios materiales basados en óxidos inorgánicos que a menudo se cree que son incombustibles, incluido el hormigón. Todo lo que entre en contacto con ClF 3 debe seleccionarse cuidadosamente y limpiarse de cualquier impureza que pueda desencadenar una combustión explosiva.
En contacto con la piel, el trifluoruro de cloro puede desencadenar la combustión de tejido vivo si se encuentra en cantidad suficiente. Se hidroliza atacando las células, en una reacción muy exotérmica que provoca quemaduras tanto térmicas como químicas, en particular por el ácido fluorhídrico liberado en los tejidos por esta hidrólisis. Este ácido es, además, tóxico, por lo que el envenenamiento metabólico se suma a las degradaciones fisiológicas provocadas por su carácter ácido.
Notas y referencias
- (en) David R. Lide, Manual de química y física , Boca Raton, CRC, 16 de junio de 2008, 89 ª ed. , 2736 p. ( ISBN 978-1-4200-6679-1 y 1-4200-6679-X ) , pág. 9-50.
- masa molecular calculada de " pesos atómicos de los elementos 2007 " en www.chem.qmul.ac.uk .
- Entrada "Clorotrifluoruro" en la base de datos química GESTIS de la IFA (organismo alemán responsable de la seguridad y salud en el trabajo) ( alemán , inglés ), consultado el 27 de mayo de 2018 (se requiere JavaScript)
- (en) David R. Lide, Manual CRC de Química y Física , CRC Press, 2009, 90 ª ed. , 2804 p. , Tapa dura ( ISBN 978-1-4200-9084-0 ).
- (en) Hitoshi Habuka Takahiro Sukenobu, Hideyuki Koda, Takashi Takeuchi y Masahiko Aihara, " Tasa de grabado de silicio con trifluoruro de cloro " , Revista de la Sociedad Electroquímica , vol. 151, n o 11,2004, G783 - G787 ( DOI 10.1149 / 1.1806391 ).
- Patente de Estados Unidos 5849092 "Proceso para limpieza de cámara de trifluoruro de cloro" .
- Patente de Estados Unidos 6034016 "Método para regenerar catalizadores ácidos de Lewis halogenados" .
- ( BEST) Board on Environmental Studies and Toxicology , Niveles de pautas de exposición aguda para sustancias químicas seleccionadas en el aire: Volumen 5 http: //books.nap.edu/catalog.php?record_id=11774 (citación en National Academies Press) , Washington, Prensa de Academias Nacionales ,2006, 267 p. , bolsillo ( ISBN 978-0-309-10358-9 , LCCN 2002275572 ) , pág. 40.
- particular ciertos misiles balísticos intercontinentales , que generalmente usan propulsores líquidos con algunas excepciones, como, al parecer, el nuevo Jericho-3 israelí.
- (en) Otto Ruff , H. Krug, " Über ein neues Chlorfluorid CIF- 3 " , Zeitschrift für anorganische und allgemeine Chemie , vol. 190, n o 1,1931, p. 602–608 ( DOI 10.1002 / zaac.19301900127 ).