Silano (familia de compuestos)
En química, los silanos son, según la definición de la IUPAC , la familia de compuestos químicos formada por un esqueleto de silicio e hidrógeno , de fórmula general bruta Si n H 2 n +2. El término se construye por capas con el de " alcanos ", sus análogos de carbono , al igual que los germanes son análogos del germanio . Al igual que los alcanos, los silanos pueden tener una estructura lineal ( n -silanos) o ramificada ( iso- y neo- silanos). Dependiendo de la longitud de la cadena, se pueden dividir en oligosilanos (cadena corta) o polisilanos. También existen en forma de compuestos cíclicos, ciclosilanos, cuyos compuestos monocíclicos tienen la fórmula general bruta Si n H 2 n.
El término silano también se usa con menos rigor para denotar derivados de hidrocarbilo y otros derivados de silanos verdaderos.
Estructura y propiedades
Si hay silanos ramificados y cíclicos , son mucho menos numerosos y diversos que los alcanos . En 2020, se conocían los silanos acíclicos lineales o ramificados que tenían hasta ocho átomos de silicio y los silanos cíclicos que tenían hasta seis átomos de silicio. Todos ellos aparecen como gases o líquidos incoloros en condiciones normales de temperatura y presión. Los polisilanos se vuelven inestables rápidamente a medida que se alargan, pero son mucho más estables como haluros o derivados sustituidos con residuos orgánicos.
Los silanos tienen propiedades similares a los alcanos a los que corresponden, como el punto de fusión , el punto de ebullición y el momento dipolar . Al igual que los alcanos , generalmente adoptan una geometría tetraédrica resultante de la hibridación sp 3 de los orbitales de unión . Sin embargo, existen diferencias fundamentales entre la química de los hidrocarburos y la de los silanos. Dado que el silicio es menos electronegativo que el carbono y el hidrógeno , los enlaces de los silanos están generalmente más polarizados que los de los compuestos de hidrocarburos análogos . Los átomos de hidrógeno enlazados tienen un carácter electronegativo y, por lo tanto, reaccionan fácilmente con los átomos de hidrógeno de los ácidos .
La energía del enlace Si - H es 378 kJ / mol , apreciablemente más baja que la del enlace C - H , que es más bien 414 kJ / mol , lo que hace que los silanos sean menos estables térmicamente que los alcanos.
Silanos lineales
La serie homóloga de silanos lineales corresponde a la fórmula Si n H 2 n +2con n = 1, 2, 3, etc.
| Silano | Fórmula | Punto de fusión | Punto de ebullición | Densidad | Masa molar |
|---|---|---|---|---|---|
| Silano | SiH 4 | −184,7 ° C | −112,1 ° C | (gas) 1,35 kg / m 3 | 32,12 g / mol |
| Disilano | Si 2 H 6 | −129,4 ° C | −14,8 ° C | (gas) 2,87 kg / m 3 | 62,22 g / mol |
| Trisilano | Si 3 H 8 | −116,9 ° C | 52,9 ° C | 0,739 g / cm 3 | 92,32 g / mol |
| Tetrasilano | Si 4 H 10 | −91,6 ° C | 108,4 ° C | 0,795 g / cm 3 | 122,42 g / mol |
| Pentasilano | Si 5 H 12 | −72,2 ° C | 153,2 ° C | 0,827 g / cm 3 | 152,52 g / mol |
| Hexasilano | Si 6 H 14 | −44,7 ° C | 193,6 ° C | 0,847 g / cm 3 | 182,62 g / mol |
| Heptasilano | Si 7 H 16 | −30,1 ° C | 226,8 ° C | 0,859 g / cm 3 | 212,73 g / mol |
| Octasilano | Si 8 H 18 | - | - | - | 242,83 g / mol |
Solo el silano SiH 4Puede almacenarse indefinidamente a temperatura ambiente: es el más estable de los silanos. En ausencia de catalizador , se descomponen a 500 ° C . Los términos superiores de la serie de silanos lineales son cada vez menos estables térmicamente y se descomponen incluso a temperatura ambiente a la luz del día, dando polímeros , silanos más ligeros e hidrógeno . El calentamiento a temperaturas más altas da como resultado la descomposición de los silanos en silicio e hidrógeno. Esto forma silano SiH 4durante la termólisis de silanos superiores y silanos sustituidos como triclorosilano HSiCl 3y trietoxisilano HSi (OCH 2 CH 3 ) 3 :
4 HSiCl 3⟶ 3 SiCl 4+ SiH 4 ; 4 HSi (OCH 2 CH 3 ) 3⟶ 3 Si (OCH 2 CH 3 ) 4+ SiH 4.Silanos ramificados y cíclicos
De tetrasilano Si 4 H 10, existen isómeros de cadena como el isotetrasilano HSi (SiH 3 ) 3, análogo de isobutano HC (CH 3 ) 3, isopentasilano SiH 3 SiH 2 SiH (SiH 3 ) 2y neopentasilano Si (SiH 3 ) 4, análogos respectivamente de isopentano CH 3 CH 2 CH (CH 3 ) 2y neopentano C (CH 3 ) 4. También existen silanos cíclicos . Estos diferentes isómeros se diferencian entre sí en varias propiedades, como los puntos de fusión y ebullición.
| Silano | Fórmula | Estructura | Punto de fusión | Punto de ebullición | Densidad | Masa molar | |
|---|---|---|---|---|---|---|---|
| Silanos ramificados | |||||||
| Isotetrasilano | Si 4 H 10 |
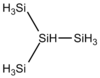
|
−99,4 ° C | 101,7 ° C | 0,793 g / cm 3 | 122,42 g / mol | |
| Isopentasilano | Si 5 H 12 | −109,8 ° C | 146,2 ° C | 0,820 g / cm 3 | 152,52 g / mol | ||
| Neopentasilano | Si 5 H 12 | −57,8 ° C | 130 ° C | - | 152,52 g / mol | ||
| Silanos cíclicos | |||||||
| Ciclopentasilano | Si 5 H 10 |
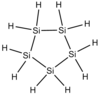
|
−10,5 ° C | 194,3 ° C | 0,963 g / cm 3 | 150,51 g / mol | |
| Ciclohexasilano | Si 6 H 12 |

|
16,5 ° C | 226 ° C | - | 180,61 g / mol | |
Reacciones
Los silanos son menos estables que los alcanos análogos. Solo se pueden producir en ausencia de aire. Los cuatro silanos más ligeros son muy reactivos y pirofóricos , es decir, pueden encenderse en el aire y explotar allí. Su combustión en oxígeno da dióxido de silicio SiO 2y agua H 2 O :
SiH 4+ 2 O 2⟶ SiO 2+ 2 H 2 O.La reactividad de los silanos disminuye para los compuestos más pesados, más allá del tetrasilano. Sin embargo, son relativamente estables en agua sin oxígeno y pueden almacenarse durante más tiempo en soluciones salinas. En agua básica , se descomponen lentamente para formar sílice e hidrógeno , una reacción que se vuelve masiva e inmediata en soluciones fuertemente básicas. La reacción se puede controlar para liberar una molécula de hidrógeno mediante enlaces Si - H y Si - H , lo que hace posible
SiH 4+ 4 H 2 O⟶ Si (OH) 4+ 4 H 2 ; SiH 4+ 2 KOH + H 2 O⟶ K 2 SiO 3+ 2 H 2.La hidrólisis de organosilanos es una reacción de primer orden . La tasa de hidrólisis del enlace Si - H depende del tipo y número de residuos orgánicos. La hidrólisis de los trialquilsilanos es significativamente más lenta que la de los triarilsilanos. Esto puede explicarse por un aumento de la densidad de electrones en el átomo de silicio bajo el efecto de los residuos de alquilo . La velocidad de reacción de los tri- n -alquilsilanos disminuye así en el orden etil > propil > butil . Entre los trialquilsilanos, los que están sustituidos con grupos n- alquilo reaccionan diez veces más rápido que los que tienen grupos alquilo ramificados isoméricos.
El silano SiH 4reacciona con metanol CH 3 OHpara dar el dimetoxisilano SiH 2 (OCH 3 ) 2, trimetoxisilano SiH (OCH 3 ) 3y tetrametoxisilano Si (OCH 3 ) 4( ortosilicato de tetrametilo ), pero no metoxisilano SiH 3 OCH 3.
La reacción de silanos con metales alcalinos disueltos en disolventes da los correspondientes derivados silílicos alcalinos. Dependiendo del disolvente, pueden tener lugar dos reacciones competitivas, por ejemplo, la primera reacción sola en hexametilfosforamida [(CH 3 ) 2 N] 3 PO(HMPA) y ambos simultáneamente en dimetoxietano CH 3 OCH 2 CH 2 OCH 3 :
2 SiH 4+ 2 K ⟶ 2 KSiH 3+ H 2 ; SiH 4+ 2 K ⟶ KSiH 3+ KH .Con los reactivos de Grignard , los silanos dan los correspondientes alquilsilanos, formando preferentemente los silanos peralquilados.
Los silanos también pueden reaccionar con nitrógeno alrededor de 500 ° C descomponiéndose, dando como resultado silicio que reacciona con nitrógeno. También es posible utilizar radiación de microondas para promover la descomposición. Esta reacción se aprovecha, por ejemplo, para depositar grandes cantidades de nitruro de silicio o para producir microcristales de este material.
Derivados del silano
Derivados halogenados
El clorosilano SiH 3 Cl, diclorosilano SiH 2 Cl 2, triclorosilano SiHCl 3y tetracloruro de silicio SiCl 4son conocidos derivados halogenados del silano SiH 4. El triclorosilano es particularmente importante en la industria porque es fácil de obtener y se utiliza como punto de partida para la producción de silano, diclorosilano y silicio ultrapura. Además de la preparación a partir de silicio y haluro de hidrógeno por el método histórico de Friedrich Wöhler , también se pueden obtener haciendo reaccionar silanos con un haluro de hidrógeno anhidro en presencia de cloruro de aluminio AlCl 3. a temperatura moderada:
SiH 4+ n HX ⟶ SiH 4– n X n+ n H 2, Donde X = Cl , Br y n = 1, 2, 3 .Si bien la reacción del silano con cloro y bromo es explosiva a temperatura ambiente, se puede realizar de forma controlada a temperaturas más bajas:
SiH 4+ Br 2⟶ SiH 3 Hab(+ H 2 SiBr 2) + HBr a -80 ° C .Organosilanos
El enlace Si - C es muy estable y, ya en 1917, Alfred Stock informó de la existencia de más de 50 tetraalquilsilanos y tetraarilsilanos. Estos compuestos son térmicamente estables, resistentes al agua y pueden ser halogenados , nitrados o sulfonados sobre el residuo orgánico sin que se rompa el enlace Si-C. El tetrametilsilano Si (CH 3 ) 4es un compuesto importante, en gran parte químicamente inerte, que se utiliza como estándar en espectroscopia de RMN . Debido a la estabilidad del enlace Si-C, es posible obtener compuestos como el hexafenildisilano Si 2 (C 6 H 5 ) 6que no tienen homólogo de carbono ( hexaphenylethane (en) C 2 (C 6 H 5 ) 6 nunca podría sintetizarse).
Los organosilanos se pueden preparar haciendo reaccionar derivados de silanos halogenados o silanos con organolíticos o mediante una reacción de Grignard :
Si 2 Cl 6+ 6 CH 3 MgCl⟶ Si 2 (CH 3 ) 6+ 6 MgCl 2.Los organohalosilanos se producen a escala industrial mediante la síntesis de Müller-Rochow :
2 CH 3 Cl+ Si ⟶ SiCl 2 (CH 3 ) 2.Silanoles, siloxanos, siliconas
La hidrólisis de los silanos, y en particular de sus derivados halogenados, da fácilmente silanoles que, a diferencia de alcoholes similares, son relativamente inestables. Se polimerizan con la eliminación de agua para dar siloxanos y siliconas , el cloruro de hidrógeno acelerar la polimerización. Los monosilanoles forman dímeros , los silanodioles forman polímeros lineales y los silanotrioles forman redes tridimensionales. Estas reacciones se ven favorecidas por el hecho de que los enlaces Si - O - Si son particularmente estables.
2 ClSi (CH 3 ) 3+ H 2 O⟶ 2 HOSi (CH 3 ) 3+ HCl ; 2 HOSi (canal 3 ) 3⟶ (CH 3 ) 3 Si - O - Si (CH 3 ) 3+ H 2 O.Aplicaciones
El triclorosilano SiHCl 3es un producto intermedio para la producción de silicio ultrapura destinado a la industria de los semiconductores , para la producción de promotores de adherencia y para tratamientos superficiales. La termólisis de silanos en atmósfera de hidrógeno también permite depositar silicio ultrapura ( proceso Siemens (de) ).
La sílice de pirólisis , que es en particular una carga comúnmente utilizada con plásticos , se puede producir a partir de clorosilanos y cloroalquilsilanos por reacción en una llama de oxihidrógeno . Los organosilanos funcionales se utilizan para el método de funcionalización de superficies llamado silanización (in) . Clorometilsilanos, en particular dimetildiclorosilano SiCl 2 (CH 3 ) 2, se utilizan como materia prima para la producción de siliconas .
Es posible depositar una fina capa de silicio oxidando el diclorosilano SiH 2 Cl 2bajo presión reducida. En el contexto de la fabricación de dispositivos semiconductores , un método de deposición química de vapor, plasma mejorado ( PECVD ) permite, en determinadas condiciones, depositar capas dieléctricas sobre dióxido de silicio SiO 2de silano SiH 4y por ejemplo monóxido de nitrógeno .
Los silanos más pesados, que ya no son pirofóricos , se han estudiado como propulsores en astronáutica . Sin embargo, tienen un coste elevado y un impulso específico menor que los propulsores hidracina o LOX / LH2 , pero compuestos como el pentasilano Si 5 H 12 podrían usarse como aditivos no tóxicos para ciertos propulsores.
Notas y referencias
- (in) " silanos " Compendium of Chemical Terminology [ " libro de oro "], IUPAC 1997, corregidos versión en línea (2006-), 2 ª ed.
- (en) NN Greenwood y A. Earnshaw, Química de los Elementos , Elsevier, 2012, p. 337 . ( ISBN 978-0-08-050109-3 )
- (en) [PDF] Barry Arkles, " Silanes ", pág. 39 , reimpresión Kirk-Othmer, Enciclopedia de Tecnología Química , 4 ª edición, vol. 22, John Wiley & Sons, 1997, pág. 38-69 . ( ISBN 0-471-52691-6 )
- (en) AF Holleman, E. Wiberg y N. Wiberg, Lehrbuch der Chemie Anorganischen , 101 ª ed., Walter de Gruyter, 1995, p. 485 . ( ISBN 3-11-012641-9 )
- (de) Bernhard Hidding, “ Untersuchung der Eignung von der Silanenals Treibstoffe en Aeronáutica y Astronáutica ” , en https://web.archive.org/ , Bundeswehr Universidad de Munich y la Universidad Heinrich Heine de Düsseldorf , enero de 2004(consultado el 23 de enero de 2021 ) .
- (in) Barry Arkles, Youlin Pan, Fernando Jove, Jonathan Goff y Alain Kaloyeros , " Síntesis y estudios exploratorios de isotetrasilano de deposición e intermedios reactivos para silicio epitaxial " , Química inorgánica , vol. 58, n o 5, 20 de febrero de 2019, p. 3050-3057 ( PMID 30785274 , DOI 10.1021 / acs.inorgchem.8b02761 , leer en línea )
- (en) James C. Sturm y Keith H. Chung , " Epitaxia de deposición de vapor químico de materiales a base de silicio usando neopentasilano " , ECS Transactions , vol. 16, n o 10, octubre de 2008, p. 799 ( DOI 10.1149 / 1.2986839 , Bibcode 2008ECSTr..16j.799S , leer en línea )
- (de) G. Schott y C. Harzdorf , “ Silane . I Alkalische Solvolyse von Triorganosilanen ” , Zeitschrift für anorganische une allgemeine Chemie , vol. 306, n huesos 3-4, Octubre de 1960, p. 180-190 ( DOI 10.1002 / zaac.19603060306 , leer en línea )
- (en) Jingwei Song Xiying Ma Zui Wang, Chen Wei y Chen Zhongpin , " Fabricación de Si 3 N 4 Nanocristales y nanocables que utilizan PECVD ” , Avances en Ciencias e Ingeniería de Materiales , vol. 2010,29 de junio de 2010, Artículo n o 892,792 ( DOI 10.1155 / 2010/892792 , leer en línea )
- (en) JR Flemish y RL Pfeffer , " Película de nitruro de silicio feliz con bajo contenido de hidrógeno de plasma de resonancia de ciclotrón de electrones " , Journal of Applied Physics , vol. 74, n o 5, Septiembre de 1993, p. 3277-3281 ( DOI 10.1063 / 1.355318 , Bibcode 1993JAP .... 74.3277F , leer en línea )
- (de) Josef Goubeau y Rudolf Warncke , “ Zur Hydrolyse von Halogeniden. I. Hidrólisis de tetracloruros de silicio ” , Zeitschrift für anorganische Chemie , vol. 259, n hueso 1-4 Julio de 1949, p. 109-120 ( DOI 10.1002 / zaac.19492590109 , leer en línea )
- (de) Eugen Unger , “ Die Erzeugung dünner Schichten. Das PECVD - Verfahren: Gasphasenabscheidung in einem Plasma ” , Chemie in unzerer Zeit , vol. 25, n o 3, Junio de 1991, p. 148-158 ( DOI 10.1002 / ciuz.19910250306 , leer en línea )
enlaces externos
- Recurso relacionado con la salud :