Oxidación de Swern
La oxidación de Swern es la oxidación dulce de alcoholes primarios y secundarios en aldehído y cetona en un medio que contiene el cloruro de oxalilo , el dimetilsulfóxido y la trietilamina .
La principal ventaja de este método radica en las condiciones suaves que compensa el uso de reactivos tóxicos ( cloruro de oxalilo , dimetilsulfóxido, liberación de monóxido de carbono ). Además, es imposible observar la oxidación adicional a ácido carboxílico en el caso de la oxidación de un alcohol primario. Este método se utiliza con mucha frecuencia en la síntesis total de productos naturales.
Los subproductos son sulfuro de dimetilo (Me 2 S), monóxido de carbono (CO), dióxido de carbono (CO 2 ) y, cuando se usa trietilamina como base, cloruro de trietilamonio (Et 3 NHCl). Dos de ellos, Me 2 S y CO, son muy tóxicos y volátiles: por lo tanto, la reacción debe realizarse bajo una campana. Me 2 S es un líquido volátil (T eb = 37 ° C ) con un olor desagradable: una forma de limitar este olor es tratarlo con ozono para transformarlo en dimetilsulfóxido inodoro.
Mecanismo
El primer paso en la oxidación de Swern es la reacción, a baja temperatura, de dimetilsulfóxido (DMSO) 1a y 1b con cloruro de oxalilo , 2 . El primer intermedio, 3 , se descompone rápidamente, liberando óxidos de carbono (CO y CO 2 ) y produciendo cloruro de dimetilclorosulfonio , 4 .
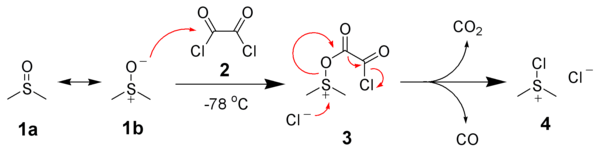
Después de la adición del alcohol 5 , el cloruro de dimetilclorosulfonio 4 reacciona con el alcohol para dar el intermedio iónico alcoxisulfonio, 6 . La adición de dos equivalentes de base, típicamente la trietilamina , desprotonará el ion alcoxisulfonio para dar el iluro de azufre , 7 . En un estado de transición que comprende un anillo de 5 miembros, el iluro de azufre se descompone para dar sulfuro de dimetilo (Me 2 S) y el aldehído o cetona deseado , 8 .

Variantes
Cuando se usa cloruro de oxalilo como agente deshidratante , la reacción debe mantenerse a una temperatura por debajo de -60 ° C para evitar reacciones secundarias. Usando anhídrido trifluoroacético en lugar de cloruro de oxalilo , la temperatura se puede aumentar a -30 ° C sin reacciones secundarias. El DMSO también se puede activar para iniciar la formación del intermedio 6 con carbodiimidas ( oxidación de Pfitzner-Moffatt ) o un complejo de trióxido de azufre-piridina ( oxidación de Parikh-Doering ).
En algunos casos, el uso de trietilamina como base puede conducir a la epimerización del carbono α del carbonilo recién formado. El uso de diisopropiletilamina (i-Pr 2 NEt, base Hünig), que es más voluminosa, puede moderar este efecto no deseado.
Nota
El subproducto de dimetilsulfuro de esta reacción tiene un olor muy desagradable. Además, las glándulas olfativas humanas son capaces de detectar este compuesto en concentraciones del orden de unas pocas partes por mil millones. Una solución sencilla a este molesto problema es enjuagar la cristalería con lejía , que puede oxidar el sulfuro de dimetilo y así eliminar el olor.