Espectrofotometria
La espectrofotometría es el campo que estudia midiendo la energía transportada por la radiación electromagnética en el rango de la luz visible. La espectrometría o espectroscopia, es un método analítico cuantitativo y cualitativo que comprende medir la absorbancia o densidad óptica de una sustancia química dada, generalmente en solución . Cuanto más concentrada es la muestra, más luz absorbe dentro de los límites de proporcionalidad establecidos por la ley de Beer-Lambert .
La densidad óptica de las muestras se determina mediante un espectrómetro previamente calibrado en la longitud de onda de absorción de la sustancia a estudiar.
Principio
Para obtener más detalles, consulte el artículo Ley de Beer-Lambert .
Cuando una luz intensa atraviesa una solución, parte de ella es absorbida por los solutos. Por tanto, la intensidad de la luz transmitida es inferior a . Definimos la absorbancia de la solución como:
.También hablamos de transmitancia definida por la relación:
es decir eso .La absorbancia es un valor positivo, sin unidad. Es tanto mayor cuanto menor es la intensidad transmitida.
La relación Beer-Lambert describe que, a una longitud de onda dada λ, la absorbancia de una solución es proporcional a su concentración y a la longitud de la trayectoria óptica (distancia sobre la cual la luz pasa a través de la solución).
Entonces, para una solución transparente que contiene una sola sustancia absorbente:
- es la absorbancia o densidad óptica (sin unidades) de la solución para una longitud de onda λ;
- (en mol.m −3 ) es la concentración de la sustancia absorbente;
- (en cm) es la longitud del camino óptico ;
- (en m 3 .mol -1 .cm -1 ) es el coeficiente de extinción molar de la sustancia absorbente en solución. Explica la capacidad de esta sustancia para absorber luz, en la longitud de onda λ.
Según la ley de Beer-Lambert, la absorbancia es aditiva (pero no transmitancia). Por tanto, para una solución que contiene varias sustancias absorbentes, la absorbancia de la solución es la suma de sus absorbancias. Para n sustancias absorbentes:
.Rango de espectrometría UV-visible
Para obtener más detalles, consulte el artículo Espectroscopia.
Un soluto o cromóforo coloreado absorbe la luz visible ( longitudes de onda entre 400 y 800 nm ). Algunas soluciones absorben en el ultravioleta (longitudes de onda inferiores a 380 nm ), esto se llama espectrometría UV . Los infrarrojos no se utilizan en espectroscopia porque dependen principalmente de la temperatura de la solución y no de su concentración , sino que están cubiertos por la espectroscopia de infrarrojos. La espectrofotometría es más específica que la espectroscopia que cubre otras longitudes de onda del espectro electromagnético .
Espectrómetro
Para obtener más detalles, consulte el artículo Espectrómetro
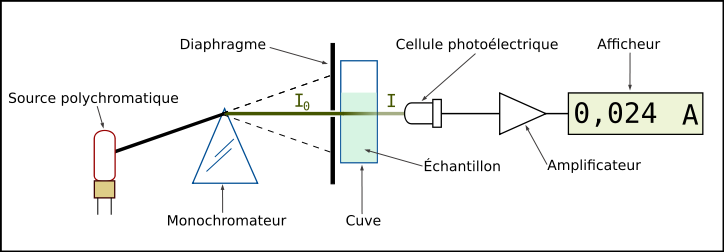 Diagrama esquemático del espectrómetro UV-visible de haz único
Diagrama esquemático del espectrómetro UV-visible de haz único
Un espectrómetro mide la absorbancia de una solución a una longitud de onda determinada. Un dispositivo monocromador permite generar, a partir de una fuente de luz visible o ultravioleta , una luz monocromática , cuya longitud de onda es elegida por el usuario. La luz incidente monocromática de intensidad pasa luego a través de un tanque que contiene la solución estudiada, y el aparato mide la intensidad de la luz transmitida. El valor mostrado por el espectrofotómetro es la absorbancia en la longitud de onda de interés. El espectrofotómetro se puede utilizar para medir instantáneamente la absorbancia a una longitud de onda determinada o para producir un espectro de absorbancia (espectrofotómetro de barrido). En este último caso, el dispositivo monocromador describe en poco tiempo todas las longitudes de onda entre dos valores elegidos por el operador.
Limites
Varios factores pueden degradar la ley de Beer-Lambert y limitar la validez de la espectrofotometría:
- el rango de medición ideal es para valores de T entre 20 y 60%;
- varias aberraciones ópticas relacionadas con la dispersión , la reflexión y la difracción de la luz pueden distorsionar la medición;
- los fenómenos de fluorescencia y otras peculiaridades químicas vinculadas a las sustancias absorbentes pueden interferir;
- cuanto mayor sea la densidad del soluto, más se refractará el haz de luz incidente con un valor dado. Esta tendencia es normalmente pequeña pero se vuelve más pronunciada con concentraciones altas. Por tanto, la refracción reduce la intensidad de la luz transmitida y el instrumento indica falsamente una mayor absorbancia. Generalmente, este fenómeno se puede evitar trabajando con concentraciones por debajo de 0.01 mol.L -1 .
Importancia del fenómeno de la difusión
Ver .
Como establece la ley de Beer-Lambert, el poder de un medio para bloquear el paso de la luz se cuantifica mediante un coeficiente de extinción dado por la ecuación:
Esta impedancia es generada por dos fenómenos distintos: absorbancia y difusión.
- La dispersión ocurre cuando la luz es desviada por partículas en el medio para que no llegue al otro lado de la muestra.
- La absorbancia es el proceso por el cual la energía luminosa es absorbida por las moléculas de la muestra antes de ser liberada como calor o almacenada como enlaces químicos.
De modo que el coeficiente de la ecuación anterior está compuesto tanto por el coeficiente de difusión ( ) como por el de absorción ( ), es decir:
El coeficiente de difusión se puede expresar por el producto de la concentración de las partículas , y la sección transversal de estas, (asumiendo que estas partículas son homogéneas y están distribuidas regularmente en el medio), tenemos:
La sección transversal, que es una medida de la proporción de luz dispersa por partícula, es función de su tamaño. De hecho, para partículas pequeñas (por ejemplo, su diámetro representa el 10% de la longitud de onda incidente) predomina la dispersión de Rayleigh . La dispersión de Rayleigh depende de la longitud del camino, la concentración de las partículas de dispersión, la longitud de onda y la polarización de estas últimas. Para una partícula idealmente esférica, la sección transversal de Rayleigh se escribe:
- es el diámetro de las partículas,
- es la longitud de onda,
- es el índice de refracción .
Esta ecuación predice que las longitudes de onda cortas serán las más dispersas.
Para partículas más grandes que la longitud de onda, están sujetas a un fenómeno más complejo llamado dispersión de Mie . Dado que la luz se dispersará en diferentes ángulos, en este caso, la forma de las partículas debe tenerse en cuenta en la sección transversal. La máxima sección efectiva se obtiene cuando el tamaño de la partícula se acerca a la longitud de onda incidente. La dispersión disminuye cada vez más a medida que aumenta la diferencia entre el tamaño de partícula y la longitud de onda (este es el caso de la espectrofotometría molecular).
Aplicaciones
Determinación de una concentración desconocidaConociendo el espectro de absorción de una sustancia química, podemos medir, en una de sus longitudes de onda (donde la absorción es máxima), las variaciones en la intensidad de un haz de luz atravesando soluciones de un mismo espesor de varias concentraciones.
Esto permite establecer experimentalmente la curva que relaciona la absorbancia y la concentración de la sustancia estudiada (con ), realizando las medidas de para diversas concentraciones. Esta curva es una curva de calibración .
La curva de calibración experimental permite determinar la concentración desconocida de una solución de esta sustancia simplemente midiendo su absorbancia y trazándola en el gráfico .
La ley de Lambert-Beer tiene límites. Es lineal solo en un rango de concentración reducido agrupando valores inferiores a 10 -2 mol.L -1 .
Seguimiento de la cinética de una reacción química.Cuando durante una reacción química de la que queremos estudiar la cinética de una de las sustancias químicas en solución, podemos por espectrofotometría de absorción seguir la concentración de esta sustancia (generalmente coloreada). Si esta sustancia es un reactivo , la absorbancia de la solución disminuye con el tiempo. Si, por el contrario, es producto de la reacción, la absorbancia de la solución aumenta con el tiempo.
Ejemplos de
- Podemos seguir la cinética de la reacción de oxidación-reducción en medio ácido , entre el ácido oxálico C 2 H 2 O 4 por el ion permanganato MnO 4 - (color púrpura) midiendo la disminución de absorbancia de este último para la longitud de onda λ = 540 nm .
Referencias
James Henkel, Fundamentos de la calidad de los productos farmacéuticos (págs. 130, 133). 1978, The Mosby Company, ( ISBN 0801600316 ) .
- Cf. G. Bruhat (2005), Óptica , sexta edición, Dunod: § Espectrofotometría.
- (in) Dispersión de luz y espectrofotometría molecular
Bibliografía
- Georges Bruhat , Optique , sexta edición, colección de cursos de referencia, Dunod, 2005, 1152 p.



























