Succinato deshidrogenasa
La succinato deshidrogenasa ( SDH ), o complejo II de la cadena respiratoria , también llamado succinato-coenzima Q reductasa ( SQR ) es una membrana oxidorreductasa que cataliza la reacción :
succinato + ubiquinona fumarato + ubiquinol .Esta enzima está presente en un gran número de seres vivos. Por tanto, se encuentra en la membrana plasmática de las bacterias y en la membrana mitocondrial interna de los eucariotas , en particular de los mamíferos . Tiene la particularidad de involucrar tanto al ciclo de Krebs como a la cadena de transporte de electrones de la fosforilación oxidativa . Constituye el segundo punto de entrada de electrones con alto potencial de transferencia a la respiración celular y asegura la transferencia de electrones desde el succinato de la matriz mitocondrial a la coenzima Q 10.disuelto en la bicapa lipídica . En los seres humanos, se sabe que el bloqueo de la succinato deshidrogenasa causa enfermedades graves ( enfermedades neurodegenerativas o tumores), con un espectro muy amplio de síntomas típicos de las enfermedades mitocondriales .
Succinato deshidrogenasa (quinona)| EC No. | EC |
|---|---|
| número CAS | |
| Cofactor (es) | FAD ; Fe-S |
| IUBMB | Entrada IUBMB |
|---|---|
| IntEnz | Vista IntEnz |
| BRENDA | Entrada BRENDA |
| KEGG | Entrada KEGG |
| MetaCyc | Camino metabólico |
| PRIAM | Perfil |
| PDB | Estructuras |
| IR | AmiGO / EGO |
Estructura y funcionamiento
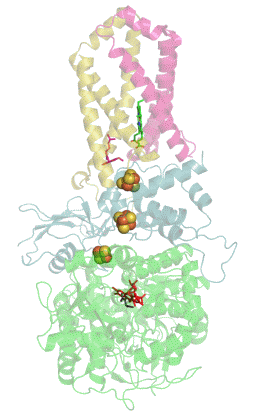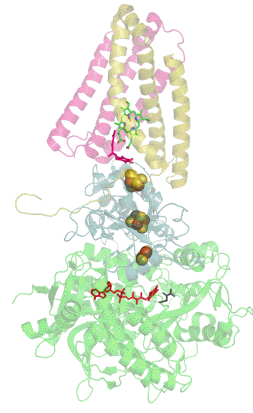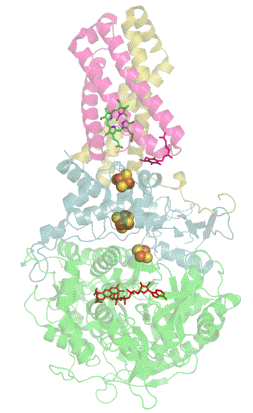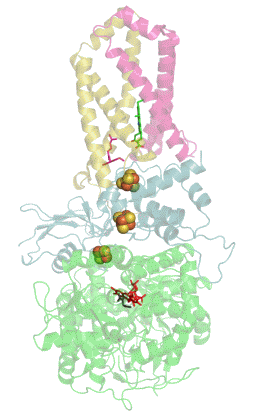
La mayoría de las succinato deshidrogenasas de bacterias y mitocondrias constan de cuatro subunidades : dos subunidades hidrófilas y dos subunidades hidrófobas . Las dos primeras son la flavoproteína SdhA y la proteína hierro-azufre SdhB, ubicadas en la matriz mitocondrial , mientras que las dos últimas se denominan SdhC y SdhD y forman el ancla de membrana de la enzima. SdhA contiene la adenina dinucleótido flavina (FAD) cofactor , así como el succinato de sitio de unión , mientras que SDHB contiene tres centros de hierro-azufre : [2Fe-2S], [4Fe-4S] y [3FE-4S]. Hay dos isoformas distintas de la subunidad SdhA en humanos (subunidades Fp tipo I y tipo II ), también presentes en Ascaris suum (en) y Caenorhabditis elegans . Las subunidades SdhC y SdhD forman un complejo de membrana con el citocromo b que comprende seis hélices transmembrana, un hemo by un sitio de unión de ubiquinona . También se encuentra una molécula de cardiolipina y una molécula de fosfatidiletanolamina que ocupan el volumen hidrófobo por debajo del hemo en las subunidades SdhC y SdhD.
-
(es) Diagrama de flujo de electrones a través del complejo II ( PDB 1YQ3 ), que ilustra la posición de los diferentes cofactores : FAD , los tres centros hierro-azufre , hemo y ubiquinona . La matriz mitocondrial está en la parte superior, la membrana mitocondrial interna está en la parte inferior.
Inhibidores
Hay dos clases distintas de inhibidores del complejo II : los que bloquean la unión de ubiquinona y los que bloquean la unión de succinato.
- Entre los primeros, hay un pesticida como la carboxina y sus derivados (gran familia de SDHI , inhibidor de SDH) y tenoiltrifluoroacetona . Se han utilizado en agricultura como fungicidas desde finales de la década de 1960 . La carboxina se utilizó principalmente para combatir enfermedades causadas por basidiomicetos como la roya y las enfermedades Rhizoctonia , luego se prohibió su uso en los campos. Más recientemente, se han desarrollado derivados de carboxina con un espectro más amplio como boscalid, pentiopirad, bixafen , fluxapiroxad, penflufen, isopirazam, flutolanil, pentiopirad, Xemium y fluopiram . Los inhibidores de SDHi no son específicos de una especie, pueden bloquear la respiración de una variedad de organismos, que van desde mohos (por ejemplo, botrytis cinerea) hasta lombrices de tierra, abejas, peces, ranas y humanos}.
Los SDHI son inhibidores que compiten con quinonas que tendrían el efecto de producir iones superóxido O 2 .. - y la aparición de estrés oxidativo . Al igual que con los antibióticos con bacterias, los hongos (mohos) pueden desarrollar resistencia, lo que hace que SDHI sea ineficaz con el tiempo.
Algunos hongos de importancia agrícola no son sensibles a los compuestos de la nueva generación de inhibidores de la unión del complejo II de ubiquinona.
- Entre estos últimos, encontramos análogos del succinato como el malonato , pero también metabolitos del ciclo de Krebs como el malato y el oxaloacetato . Este último es uno de los inhibidores más potentes del complejo II , que tendría un efecto beneficioso al limitar la producción de iones superóxido O 2 .• - por transferencia inversa de electrones en NADH deshidrogenasa ( complejo I ).
Notas y referencias
- Los valores de masa y número de residuos indicados aquí son los del precursor de la proteína resultante de la traducción del gen , antes de las modificaciones postraduccionales , y pueden diferir significativamente de valores correspondientes para la proteína funcional.
- (en) Kayode Oyedotun S. y Bernard D. Lemire , " La estructura cuaternaria de la succinato deshidrogenasa de Saccharomyces cerevisiae. Estudios de modelado de homología, acoplamiento de cofactores y simulación de dinámica molecular ” , Journal of Biological Chemistry , vol. 279, n o 10, 5 de marzo de 2004, p. 9424-9431 ( PMID 14672929 , DOI 10.1074 / jbc.M311876200 , leer en línea )
- P. Benit et al. , Patologías vinculadas a los déficits del ciclo de Krebs. Revista Francófona de Laboratorios N ° 501 2018. {{DOI: 10.1016 / S1773-035X (18) 30120-5}}
- S. Loublier y col. , Enfermedades mitocondriales: ¿un medicamento aparte? 2009. DOI : 10.1016 / j.immbio.2009.08.002
- (en) Eriko Tomitsuka Hiroko Hirawake, Yu-ichi Goto Masafumi Taniwaki, Shigeharu Harada y Kiyoshi Kita , " Evidencia directa de dos formas distintas de la subunidad de flavoproteína del complejo mitocondrial humano II (succinato-ubiquinona reductasa) " , Journal of Biochemistry , vol. 134, n o 2 agosto de 2003, p. 191-195 ( PMID 12966066 , DOI 10.1093 / jb / mvg144 , leer en línea )
- (en) Li-shar Huang Gang Sun, David Cobessi, Andy C. Wang, John T. Shen, Y. Eric Tung, Vernon E. Anderson y Edward A. Berry , " El ácido 3-nitropropiónico es un inhibidor suicida de la mitocondria Respiración que, tras la oxidación por el complejo II, forma un aducto covalente con una arginina de base catalítica en el sitio activo de la enzima ” , Journal of Biological Chemistry , vol. 281, n o 9,21 de diciembre de 2005, p. 5965-5972 ( PMID 16371358 , PMCID 1482830 , DOI 10.1074 / jbc.M511270200 , leer en línea )
- V. Graillot et al. , Evidencia de la genotoxicidad in vitro de plaguicidas metil-pirazol en células humanas. Mutat Res. 2012. DOI : 10.1016 / j.mrgentox.2012.05.014 leer en línea
- Qian et al. , Efectos tóxicos de boscalid en adultos de pez cebra (Danio rerio) sobre el metabolismo de carbohidratos y lípidos. Contaminación ambiental
- S. Wu y col. , Toxicidad simple y mixta de estrobilurina y fungicidas SDHI para embriones de Xenopus tropicalis. Ecotoxicología y seguridad ambiental
- LH Liao y col. , respuestas conductuales de las abejas melíferas (Apis mellifera) a los xenobióticos naturales y sintéticos en los alimentos, 2017, Sci Rep. DOI : 10.1038 / j.immbio.s41598-017-15066-5
- (in) Hervé F. Avenot y Themis J. Michailides , " Progresos en la comprensión de los mecanismos moleculares y la evolución de la resistencia a los fungicidas inhibidores de succinato deshidrogenasa (SDHI) en hongos fitopatógenos " , Crop Protection , vol. 29, n o 7, julio 2010, p. 643-651 ( DOI 10.1016 / j.cropro.2010.02.019 , leer en línea )
- (en) Tiphaine Dubos Matias Pasquali, Friederike Pogoda, Angela Casanova, Lucien Hoffmann y Marco Beyer , " Diferencias entre les succinato deshidrogenasa secuencias de sensorial isopirazam tritici Zymoseptoria e insensible Fusarium graminearum cepas " , plaguicidas Bioquímica y Fisiología , Vol. 105, n o 1, enero 2013, p. 28-35 ( PMID 24238287 , DOI 10.1016 / j.pestbp.2012.11.004 , leer en línea )
- (en) Florian L. Muller, Yuhong Liu, A. Muhammad Abdul Ghani, Michael S. Lustgarten, Arunabh Bhattacharya Youngmok C. Jang y Holly Van Remmen , " Altas tasas de generación de superóxido en mitocondrias del músculo esquelético que respiran en ambos complejos I - y sustratos ligados al complejo II ” , Biochemical Journal , vol. 409, n o 2 15 de enero de 2008, p. 491-499 ( PMID 17916065 , DOI 10.1042 / BJ20071162 , leer en línea )